|
В эксперименте стремятся получить равновесные отношения
в исследуемой системе. До 60-х годов нынешнего века практически все эксперименты,
в том числе и по изучению минеральных равновесий, проводились методом
синтеза. Выявляемые в таких опытах поля (по задаваемым параметрам)
синтеза фаз в большинстве случаев не соответствуют истинным пределам их
термодинамической устойчивости. Выяснилось, что
на положение границ полей синтеза оказывают, кроме продолжительности опытов,
способы приготовления исходных веществ, снаряжения ампул и многое другое.
Ускорению реакций, ведущих к более быстрому достижению равновесных отношений,
в различной степени и в разных конкретных случаях способствуют проведение
опыта в присутствии водного флюида или каких-либо
других жидких фаз (в том числе расплавов); использование наиболее реакционноспособных
исходных веществ (стекол, гелей,
как это описано в соответствующем разделе); покачивания, вибрации или
встряхивания реакторов, использования мешалок, применения сдвиговых напряжний
в процессе опыта и т.д.
В любом случае экспериментатор должен отдавать себе отчет, насколько
его результаты отвечают равновесным отношениям или показывают тенденцию
к таковым. Строгость выбора критериев равновесия и изобретательность в
этом отношении исследователя во многом определяют его авторитет.
Безукоризнен термодинамический критерий
равновесных отношений: минимальное значение свободной
энергии Гиббса (G=min, dG=0, d2G> 0). Все прочие состояния
системы неустойчивы и самопроизвольно переходят в стабильные. Напрямую
его применяют при сравнении экспериментально установленного равновесия
с рассчитанным по термохимическим данным. В остальных
случаях используют следствия главных термодинамических отношений, в частности
применимость к результатам правила фаз. Это
обязательный и очень полезный признак, который необходим, но обычно недостаточен
в качестве критерия равновесия.
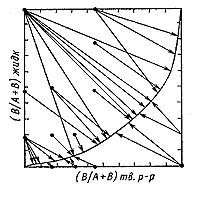 |
| Рис. 142. Подход к равновесию с двух
сторон по составу на примере обменного равновесия щелочной полевой
шпат √ водный раствор (по П.Орвиллю). |
Другое следствие общего термодинамического критерия -
независимость конечного равновесного состояния от предыстории
процесса. Отсюда непосредственно следует один из самых распространенных
методов установления равновесных отношений - подход к равновесию с
двух сторон. Это
может быть подход "сверху-снизу" по задаваемым условиям эксперимента (температуры,
давления...), по составу или по состоянию исходных веществ. Определение
температуры ликвидуса, например, проводят по исчезновению
кристаллических фаз при повышении температуры и по их первому появлению
- при понижении. Подход с разных сторон по составу используют при изучении
равновесных отношений между жидким и твердым растворами переменного состава.
Равновесие устанавливается при ионном обмене компонентов
А и В: А(жидк.) + В(тв.) 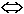 А(тв.)
+ В(жидк). В части опытов в исходной жидкой фазе преобладает компонент
В, а в твердой -компонент А (стрелки на рис.
142, направленные слева-сверху вниз-направо), в другой части -
наоборот (стрелки, направленные снизу-справа вверх-налево). Если концы
стрелок в пределах точности анализов отрисовывают одну и ту же кривую,
она отражает равновесные отношения. Исходные составы изучаемых систем
могут быть заданы в виде нескольких различных комбинаций веществ: оксидов
или более сложных соединений, кристаллических или аморфных и т.д. Если
во всех подобных случаях получается один и тот же результат, это тоже
служит критерием равновесия. Сказанное можно сформулировать и по-другому,
как частный случай воспроизводимости результата разными методами,
на которой основана вообще оценка достоверности любого экспериментального
исследования. А(тв.)
+ В(жидк). В части опытов в исходной жидкой фазе преобладает компонент
В, а в твердой -компонент А (стрелки на рис.
142, направленные слева-сверху вниз-направо), в другой части -
наоборот (стрелки, направленные снизу-справа вверх-налево). Если концы
стрелок в пределах точности анализов отрисовывают одну и ту же кривую,
она отражает равновесные отношения. Исходные составы изучаемых систем
могут быть заданы в виде нескольких различных комбинаций веществ: оксидов
или более сложных соединений, кристаллических или аморфных и т.д. Если
во всех подобных случаях получается один и тот же результат, это тоже
служит критерием равновесия. Сказанное можно сформулировать и по-другому,
как частный случай воспроизводимости результата разными методами,
на которой основана вообще оценка достоверности любого экспериментального
исследования.
Особо убедительно свидетельствует о равновесных отношениях наличие у
экспериментальных результатов предсказательной силы.
Рассмотрим простой пример. В опыте получены две фазы и определены их
составы. Если эти отношения равновесны, исходный состав опыта лежит на
конноде, любая точка которой легко рассчитывается линейной интерполяцией
составов сосуществующих фаз. При данных условиях опыта такие точки изображают
смесь этих фаз, причем строго с тем же фиксированным составом, но в различных
количественных отношениях. Этот вывод легко проверить постановкой одного
контрольного опыта.
Для отличия стабильных в условиях опыта фаз от метастабильных
нужно достаточно хорошо знать кинетику реакций. Многое в этом отношении
дает применение метода кинетических кривых.
Кривая, показывающая изменение количества образующихся фаз в зависимости
от продолжительности эксперимента, строится на основе серии опытов, строго
одинаковых по условиям (температура, давление, состав смеси, величина
навески и способ ее приготовления и др.) и различающихся только длительностью.
Оказалось, что в гидротермальных опытах с аморфными
исходными смесями ассоциация образующихся фаз представляет продукт сложной
многоступенчатой реакции, протекающей в общем случае
по следующей схеме: (1) растворение исходных веществ и образование растворимых
комплексов; (2) возникновение зародышей кристаллических фаз, стабильных
и (или) метастабильных в условиях опыта; (3) рост фаз; (4) разложение
метастабильных фаз; (5) кристаллизация только стабильных фаз.
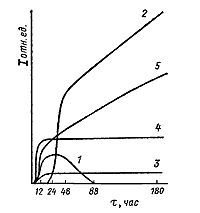 |
| Рис. 143. Изменение относительных интенсивностей
характерных рентгеновских пиков мусковита (1), санидина (2), х-андалузита
(3), муллита (4) и корунда (5) в опытах по кинетике раскристаллизации
гелевой смеси системы K2O - Al2O3
- SiO2 при температуре 6800С ( по Фонареву В.И.). |
Эти закономерности можно проследить на примере раскристаллизации
гелевой смеси оксидов калия, кремния и алюминия при температуре 680оС
и 1 кбар (см. рис. 143). В сложном
кинетическом механизме процесса наблюдается сочетание параллельных и последовательных
реакций. Из исходной смеси одновременно образуются зародыши и происходит
кристаллизация ряда фаз: мусковита, х-андалузита, муллита, корунда (параллельные
реакции). После 24 часов начинается
разложение метастабильного мусковита с образованием санидина (последовательные
реакции). В то же время метастабильный
муллит не проявляет признаков разложения.
Кристаллизация всех фаз, как стабильных, так и метастабильных,
интенсивна уже в течение 6-24 часов опыта. Именно скорость разложения
метастабильных фаз определяет в основном скорость всего процесса. Очевидно,
для их разложения требуется большая энергия активации.
Стадия образования зародышей не оказывает существенного влияния на длительность
всего процесса. В методе синтеза, очевидно, процесс доходил до 3-ей, иногда
захватывал 4-ую стадию. 5-ая стадия, которая только и может фиксировать
условия термодинамического равновесия, достигалась
только в очень редких случаях, преимущественно в условиях высоких температур.
Из рассмотренных кинетических особенностей реакций непосредственно
вытекает идея миновать процесс синтеза и сразу начать опыт с 4-ой или
5-ой стадии. На этом основан метод моновариантной реакции.
При его применении изучается заранее известное моновариантное
равновесие. Для этого в состав исходной навески включают кристаллические
фазы, участвующие в данной реакции (в количествах, соответствующих коэффициентам
в ее уравнении), как в правой, так и в левой ее части. Температуру равновесия
оценивают по сдвигу реакции (изменению относительного количества фаз)
в ту или другую сторону. Вводя в опыт заранее синтезированные или природные
минералы мы минуем начальные стадии многоступенчатой реакции - растворение
исходных веществ, образование зародышей и рост кристаллических фаз. При
этом предотвращается синтез метастабильных фаз, не участвующих в данном
равновесии. Выявление направления реакции однозначно показывает стабильную
в данных условиях ассоциацию минералов, а следовательно, позволяет не
требует обязательно достижения полного равновесия в системе.
В методе моновариантной реакции требуется контроль за
изменением количества фаз. Обычно используют рентгеновский
метод - проводят анализ интенсивностей характерных отражений фаз.
Это относительный метод, сравниваются интенсивности, а не непосредственно
количества фаз.
Анализ интенсивностей отражений - не рядовая задача для рентгенофазового
анализа. Она требует строго одинакового приготовления всех образцов в
отношении количества вещества, крупности зерен, толщины слоя порошка,
соблюдения одинаковых условий съемки. Даже при соблюдении всех этих условий
смещение относительных количеств фаз фиксируется с точностью не менее
± 15 относительных %.
Большие ошибки, связанные с неоднородностью материала, а также текстурированием
изучаемой фазы, сглаживают, используя не сами интенсивности, а их отношения
для фаз правой (пр.) и левой (лев.) части реакции в исходной навеске (исх.)
и в продуктах опыта (оп.). Чтобы величины были соизмеримыми при сдвиге
реакции вправо и влево, в первом случае берут отношение I1
= (Iлев / Iпр)оп / (Iлев /
Iпр)исх , а во втором I2 = (Iпр
/ Iлев)оп /(Iпр / Iлев)исх
. На графике зависимости от температуры (см. рис. 144)
I1 откладывают вверх, а I2 - вниз от горизонтальной
линии, соответствующей отсутствию сдвига реакции, при котором оба отношения
будут равны 1.
Другой применяемый метод контроля - весовой. Он требует разделения минералов
- участников реакции и их взвешивания с большой точностью. Для разделения
минералов предложено несколько способов. Минералы, относящиеся к одной
стороне реакции, берут в виде тонко измельченного порошка (пудры), а к
другой - в виде монокристаллов. Сходный способ применяется для равновесий
с участием кварца. В реакторе подвешивается точно взвешенный кристаллик
кварца. Уменьшение или увеличение его веса после опыта свидетельствует
о сдвижении равновесия в соответствующую сторону, а точное сохранение
веса - о достижении равновесия. Другой способ заключается в том, что минералы
помещают в разные контейнеры (ампулы) или в разные части одной большой
гофрированной ампулы (метод "пережатой ампулы"). Реакция осуществляется
через общую флюидную фазу. Преимущество подобного метода заключается в
прямом определении изменения количеств минералов. Трудность его применения
связана с возможностью потери тонкозернистого материала при возникновении
конвекционных потоков, а также с налипанием и сорбцией на кристаллах посторонних
частичек.
Возможно использование и других методов, позволяющих
прослеживать изменение количеств фаз в опытах. Например, иногда подсчитывают
количество зерен различных фаз при просмотре на микроанализаторе.
Ограничением подобного метода является то, что выпадают из подсчета зерна,
меньшие разрешающей способности метода и образующие полиминеральные агрегаты.
Перспективны методы радиоактивных
(и вообще изотопных) меток.
Метод моновариантной реакции разработан для равновесий с минералами постоянного
состава. Делались попытки применения его главных принципов и для более
сложных реакций с минералами - твердыми растворами. В качестве исходной
смеси использовали ассоциацию минералов с определенными соотношениями
их составов. Отсутствие термодинамической устойчивости фиксировали по
смещениям составов минералов, устанавливаемых с помощью электронного микроанализатора.
Варьируя параметры опытов, устанавливали условия, при которых такого смещения
не происходит.
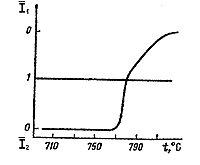 |
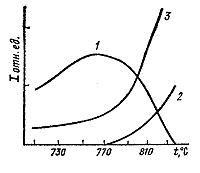
| Рис. 144. Определение температуры равновесия
методом моновариантной реакции по соотношению рентгеновских интенсивностей
исходных фаз I2 и I1 (по В.И.Фонареву). |
Полностью сопоставимые результаты с методом моновариантной
реакции дает изохронный метод, в
котором изучается изменение количества синтезируемых в процессе эксперимента
фаз в зависимости от температуры при постоянной продолжительности опытов.
В качестве исходных используют высокореакционные смеси (гели, стекла)
требуемого состава. Количества фаз оценивают рентгеновским
методом. Было показано, что количество метастабильной фазы асимптотически
уменьшается с температурой, а количеств стабильной - увеличивается. Температура
равновесия изучаемой реакции фиксируется по перегибу кривой на графике
количество фазы - температура (рис.
145). Графики на рис. 144
и 145 приведены для одной
и той же реакции мусковит = санидин + корунд при РН2О
= Робщ = 8000 бар.
 |
| Рис. 145. Изменение относительных интенсивностей
характерных рентгеновских пиков мусковита (1), санидина (2) и корунда
(3) в изохронных опытах по определению температуры дегидратации мусковита
при РН2О=Робщ.=8000 бар (по ВИ Фонареву). |
Уравнения, связывающие термодинамические и кинетические
параметры, дают возможность сделать некоторые выводы, практически важные
при использовании того или иного метода оценки критериев равновесия. Отношение
констант скоростей прямой и обратной реакции (константа
равновесия) определяется величиной свободной энергии
Гиббса системы при данных температуре и давлении. Чем больше абсолютная
величина последней, тем больше общая результирующая скорость реакции,
причем отношение скоростей прямой и обратной реакции находится в степенной
зависимости от их термодинамических констант: К1/К2
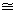 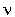 е- е-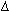 Н/RTe
Н/RTe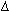 S/R, где К1 - константа скорости прямой реакции,
К2 - то же обратной,
S/R, где К1 - константа скорости прямой реакции,
К2 - то же обратной, 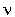 - предэкспоненциальный множитель (фактор частоты), е - основание
натуральных логарифмов.
- предэкспоненциальный множитель (фактор частоты), е - основание
натуральных логарифмов.
Разность энергий прямой и обратной реакций обусловлена
тепловым
(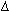 Н),
а отношение частотных факторов - энтропийным эффектом ( Н),
а отношение частотных факторов - энтропийным эффектом (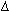 S) реакции. При существенных величинах
S) реакции. При существенных величинах  Н и
Н и  S
реакция проходит практически необратимо. Эти величины определяют, в каких
реакциях могут быть получены самые надежные и контрастные результаты.
Увеличение температуры вызывает увеличение скорости реакции: dlnW/dT
= dlnK/dT = dlnA/dT + Е/RT2, где
W - скорость реакции, К - константа равновесия. S
реакция проходит практически необратимо. Эти величины определяют, в каких
реакциях могут быть получены самые надежные и контрастные результаты.
Увеличение температуры вызывает увеличение скорости реакции: dlnW/dT
= dlnK/dT = dlnA/dT + Е/RT2, где
W - скорость реакции, К - константа равновесия.
Анализируя последнее уравнение, можно показать, что
производная скорости реакции (константы реакции)
по температуре всегда положительна, причем увеличение температуры уменьшает
активационный барьер (Е/RT2) и увеличивает
число активных состояний системы (фактор А). Таким образом, при более
высокой температуре скорость реакции больше.
Изменение свободной энергии с температурой является
энтропийным эффектом реакции
dG/dT = - S. Очевидно, что чем он больше, тем значительнее изменяется скорость реакции
с температурой. Следовательно, более надежные и контрастные результаты
могут быть получены для реакций с большим энтропийным эффектом.
S. Очевидно, что чем он больше, тем значительнее изменяется скорость реакции
с температурой. Следовательно, более надежные и контрастные результаты
могут быть получены для реакций с большим энтропийным эффектом.
Дополнительная литература
Фонарев В.И. Экспериментальные
критерии равновесия при изучении гидротермальных систем с минералами постоянного
состава. - В кн. "Очерки физико-химической петрологии", вып. IV, М, 1974.
|

