 Метод
охлаждения образца и замораживания
находящихся во включении газов и жидкостей
называется криометрией. Для криометрии
обычно используется жидкий азот, который
подается в кожух рабочей камеры и охлаждает
образец. Пример выпускаемой
промышленностью установки (фирма Linkam Sci. Instr.)
для изучения газово-жидких включений
приведен на рис. В данной конструкции
применяется плоский нагревательный
элемент (до 600° C),
расположенный под образцом. Это позволяет
добиться минимальных температурных
градиентов внутри камеры. Блок в котором
смонтированы нагреватель, термопара и
столик для образца - серебряные. Это
позволяет добиться (за счет большой
теплопроводности серебра) больших
скоростей нагрева и охлаждения (90°
/мин.) и выравнивать температурные
градиенты при быстром нагреве.
Непосредственно к столику (во время
криометрии) подается жидкий азот, что
позволяет охлаждать образец до -180°
C. Отдельно предусмотрена продувка
газообразным азотом камеры и оптических
систем для того, чтобы во время криометрии
на рабочих поверхностях не
конденсировалась влага и не затрудняла
визуальное наблюдение за ходом
эксперимента. Верхнее и нижнее окна сделаны
из кварцевого стекла, окно в нагревателе -
из сапфира. Сапфировое окно необходимо для
нейтрализации (по методу дополнительных
окрасок) света испускаемого нагревательной
спиралью при высоких температурах.
Метод
охлаждения образца и замораживания
находящихся во включении газов и жидкостей
называется криометрией. Для криометрии
обычно используется жидкий азот, который
подается в кожух рабочей камеры и охлаждает
образец. Пример выпускаемой
промышленностью установки (фирма Linkam Sci. Instr.)
для изучения газово-жидких включений
приведен на рис. В данной конструкции
применяется плоский нагревательный
элемент (до 600° C),
расположенный под образцом. Это позволяет
добиться минимальных температурных
градиентов внутри камеры. Блок в котором
смонтированы нагреватель, термопара и
столик для образца - серебряные. Это
позволяет добиться (за счет большой
теплопроводности серебра) больших
скоростей нагрева и охлаждения (90°
/мин.) и выравнивать температурные
градиенты при быстром нагреве.
Непосредственно к столику (во время
криометрии) подается жидкий азот, что
позволяет охлаждать образец до -180°
C. Отдельно предусмотрена продувка
газообразным азотом камеры и оптических
систем для того, чтобы во время криометрии
на рабочих поверхностях не
конденсировалась влага и не затрудняла
визуальное наблюдение за ходом
эксперимента. Верхнее и нижнее окна сделаны
из кварцевого стекла, окно в нагревателе -
из сапфира. Сапфировое окно необходимо для
нейтрализации (по методу дополнительных
окрасок) света испускаемого нагревательной
спиралью при высоких температурах.
Микротермометрия.
Наблюдения за фазовыми переходами при
изменении температуры является основным
методом при изучении флюидных включений.
Используя специальную аппаратуру,
помещаемую на столик микроскопа,
проводятся наблюдения за фазовыми
изменениями во включении, происходящие при
изменении температуры. Обычно образец
исследуют при охлаждении (криометрия) и
нагреве (термометрия). Все измерения
производят только при повышающейся
температуре, т. к. при охлаждении сильно
развиты явления метастабильности и,
например, появление пузырька газа или
замерзание включения происходит при
переохлаждении иногда на несколько
десятков градусов.
Криометрия. При
отрицательных температурах обычно
замеряются следующие температуры.
а) Температура эвтектики водно-солевых
включений - появление первых порций
жидкости после полного замораживания.
Часто замерить ее не удается вследствие
малого размера включения. По температуре
эвтектики можно судить о валовом составе
включения, например, если замеренная
температура равна -21,3оС, во включении
присутствуют растворы NaCl, если она
соответствует -51,5оС, - растворы NaCl CaCl2.
Значения температур эвтектики для многих
растворов, присутствующих во включениях,
известны и имеются во всех химических
справочниках;
б) Температуры плавления льда и
кристаллов солей, выпавших при охлаждении
водно-солевых включений. Если мы имеем дело
с недосыщенными растворами одной соли,
после плавления эвтектики остаются только
кристаллики льда. В зависимости от
концентрации соли они снижают температуру
плавления льда. На этом основан метод
определения концентрации соли во включении.
Однако, поскольку часто неизвестно, какие
именно соли содержатся в изучаемых
включениях, для выражения концентрации
принято пользоваться понятием NaCl-эквивалент
(NaCl-экв) - концентрацию соли определяют,
принимая, что во включении присутствует
только NaCl. Ясно, что при измеренных
температурах плавления льда ниже, чем -21,3оС
выразить концентрацию в NaCl-экв невозможно.
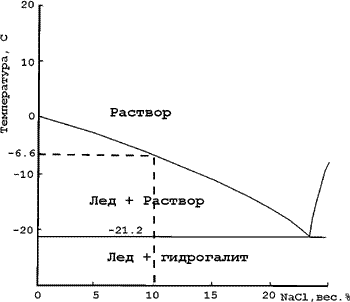 |
На рис. показана фазовая
диаграмма системы H2O-NaCl при низких
температурах и способ определения
концентрации соли во включении на
примере полученного замера -6,6оС -
в растворе содержится 10 масс.% NaCl. При
содержании NaCl в растворе больше 23,2%,
после плавления эвтектики остается фаза
гидрогалита, которую диагностирут по
более высокому рельефу и очень
медленной динамике растворения. Тогда
для определения концентрации
пользуются другой ветвью плавления на
диаграмме состояния. |
Часто раствор во включении
представлен тройной водно-солевой системой.
Тогда после плавления эвтектики измеряются
температуры исчезновения нескольких фаз,
последовательность растворения которых
зависит от общего состава включения. Если
известна соответствующая фазовая
диаграмма системы, интерпретация
полученных замеров возможна. Однако
следует отметить, что такие данные очень
ограничены.
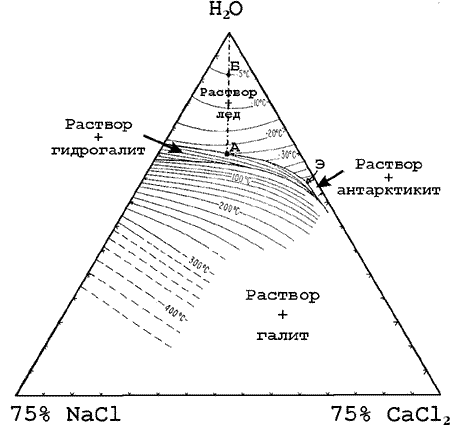 |
Для примера рассмотрим систему H2O-NaCl-CaCl2,
приведенную на рис.. При -51,5оС -
температуре эвтектики (точка Э) -
появятся первые порции жидкости. При
повышении температуры состав жидкости
будет изменяться по котектической линии,
пока не произойдет полное плавление
гидрогалита и останется одна твердая
фаза - лед (например, до точки А, при -25оС).
Состав жидкости далее будет изменяться
вдоль линии, соединяющей точку А с
точкой воды. Пересечение этой линии с
изотермой плавления льда (примем, что
лед расплавился при -5оС) является
фигуративной точкой валового состава
включения (точка Б). В нашем примере в
растворе содержится: 5 масс% NaCl и 4 мас.%
CaCl2. Аналогичным способом
определяется валовый состав раствора,
если фигуративная точка его лежит в
других полях фазовой диаграммы. |
в) Во включениях, содержащих
летучие в сжиженном виде (прежде всего речь
идет об углекислоте, а также о H2S, CH4
и т.п.), измеряют температуру плавления
твердой фазы. По ней судят о природе
жидкости и о наличии примесей других
летучих. Например, температура тройной
точки (плавления) сероводорода -82,9оС,
чистая углекислота плавится при -56,6оС,
примесь азота или метана снижают
температуру плавления. Если известно, какой
газ присутствует в виде примеси и степень
влияния его на свойства смеси, по изменению
температуры плавления можно
приблизительно оценить его количество.
г) Так как критические
температуры почти всех летучих компонентов,
кроме воды флюидных включений лежат в
области отрицательных температур,
температуры перехода жидкость-пар измеряют
при криометрии. Если включение не содержит
других компонентов, эта температура
является температурой гомогенизации; в
присутствии еще и водной фазы -
температурой частичной гомогенизации.
Рассмотрим для примера самый простой
случай: чисто углекислотное включение.
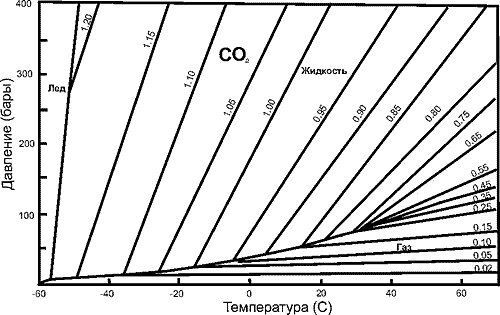 |
Критическая температура СО2
равна 31,06оС. Критическую и тройную
точку соединяет на диаграмме состояния (рис.
137) кривая равновесия жидкость-пар. В
каждой точке этой кривой начинаются две
изохоры: жидкости (с плотностью выше
критической) и газа (с плотностью ниже
критической). В этой точке углекислота,
имеющая плотность, соответствующую
одной из изохор, полностью перейдет или
в жидкое или в газообразное состояние.
Например, во включении при температуре -5оС
газовый пузырек полностью растворился в
жидкости: произошла гомогенизация в
жидкую фазу. На диаграмме состояния в Р-Т
координатах при этой температуре
начинается изохора 0,956г/см3, таким
образом, мы определили плотность
включения. Последнее имеет постоянный
объем, поэтому точка захвата его лежит
на указанной изохоре. Отсюда следует,
что если известна температура (или
давление) образования этого включения,
можно определить второй независимый
параметр захвата: давление (температуру).
Например: температуре образования 350оС
для нашего включения соответствует
давление 2750 бар. Если бы при той же
температуре -5оС во включении
произошла гомогенизация в газовую фазу (расширение
пузырька до объема всего включения за
счет жидкой фазы), плотность флюида во
включении соответствовала бы 0,082г/см3.
|
Данные по равновесию жидкость-пар
известны практически для всех чистых
систем летучих, встречающихся во
включениях.
д) Если во включении наряду с
газом присутствует вода, при низких
температурах начинается образование так
называемых газгидратов (клатратов) -
твердых веществ переменного состава типа СО2,хН2О.
Понятно, что измерять плотность в
присутствии клатратов не имеет смысла, так
как часть вещества включения израсходована
на формирование высокоплотной твердой фазы.
Однако, наблюдения за клатратами могут дать
полезную информацию. Клатраты в чистой
системе Н2О-СО2 не существуют
при температуре выше 11оС. Если в воде
растворена соль, температура плавления
клатрата снижается пропорционально ее
концентрации. Таким образом, измеряя
температуру плавления клатрата (в
присутствии газовой и жидкой фаз СО2),
оценивают содержание соли в воде.
Термометрия. При нагреве
включений измеряют следующие температуры.
| а) Температуру растворения
кристаллов солей в пересыщенных при
комнатной температуре растворах. Во
включениях можно наблюдать один или
несколько кристалликов солей. Наиболее
часто - это галит, реже -сильвин, еще реже -
карбонаты, сульфаты и другие плохо
растворимые соли. На рис.приведена
температурная зависимость растворимости
NaCl, с помощью которой, измерив температуру
растворения соли, можно определить
концентрацию ее во включении. Рис. взят из [Граменицкий
и др. 2000] |
 |
б) Измеряя температуру
равновесия жидкость-пар, мы определяем
плотность содержимого включения,
аналогично тому, как это делалось при
криометрии для включений чистой
углекислоты. Однако, в случае растворов
солей интерпретация полученных температур
сложнее, чем для чистых систем. Дело в том,
что растворенные соли вызывают изменение
положения кривой жидкость-пар и наклона
изохор по сравнению с кривыми для чистой
воды.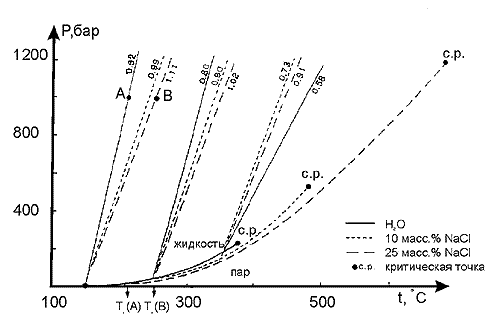 Чем больше концентрация соли, тем круче
угол наклона изохор и тем выше критические
параметры (рис. 139). Было показано, что для
хлоридов металлов 1 и 2 групп наклон изохор
для растворов, с концентрацией меньшей 15масс.%
близок к наклону изохор в системе H2O-NaCl,
и поэтому, а также потому, что P-V-T данные для
для других систем отрывочны или полностью
отсутствуют, при интерпретации измерений
пользуются диаграммами для растворов NaCl.
Очень часто исчезновение газового пузырька
(или жидкой фазы) является последним
фазовым изменением во включении, то есть
включение становится гомогенным. В таком
случае температура гомогенизации является
минимальной температурой образования; и
включение могло быть захвачено на любой
точке вычисленной изохоры.
Чем больше концентрация соли, тем круче
угол наклона изохор и тем выше критические
параметры (рис. 139). Было показано, что для
хлоридов металлов 1 и 2 групп наклон изохор
для растворов, с концентрацией меньшей 15масс.%
близок к наклону изохор в системе H2O-NaCl,
и поэтому, а также потому, что P-V-T данные для
для других систем отрывочны или полностью
отсутствуют, при интерпретации измерений
пользуются диаграммами для растворов NaCl.
Очень часто исчезновение газового пузырька
(или жидкой фазы) является последним
фазовым изменением во включении, то есть
включение становится гомогенным. В таком
случае температура гомогенизации является
минимальной температурой образования; и
включение могло быть захвачено на любой
точке вычисленной изохоры.
в) Во включениях нередко
встречаются две жидкие флюидные фазы. Самый
распространенный такой случай - это водно-углекислотные
включения. Тогда при термометрии измеряют
температуру растворения одной фазы в
другой, то есть температуру полной
гомогенизации включения (температуру
частичной гомогенизации углекислоты
определяют криометрией). Основываясь на
P-V-T-X свойствах бинарной системы Н2О-СО2,
можно рассчитать состав флюида, определить
положение соответствующей изохоры,
рассчитать давление захвата. Созданы
различные графические палетки для оценки
мольной доли углекислоты во флюиде,
валового мольного объема включения,
давления захвата и пр., одна из них
приведена на рис.
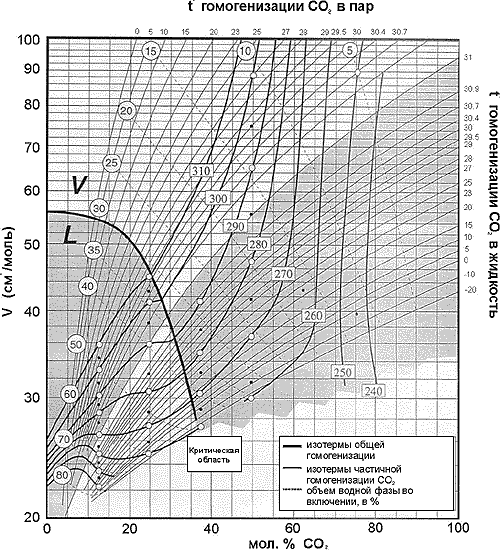 |
Для пользования палеткой
необходимо замерить температуры
частичной (СО2) и полной
гомогенизации и объемные соотношения
водной и углекислотной фаз. Например,
углекислота во включении
гомогенизировалась в жидкую фазу при 20оС,
температура общей гомогенизации 260оС,
водная фаза во включении при 40оС (при
этой температуре минимальна взаимная
растворимость воды и углекислоты)
занимает 15% объема флюидного включения.
Пересечение соответствующих линий
показывает, что мольная доля СО2
составляет 66%, мольная объем -43,5 см3/моль.
Зная это, можно по положению изохоры в Р-Т
пространстве определить температуру
или давления захвата, если известен один
из этих параметров. Как и все палетки,
палетка, приведенная на рис.имеет
некоторые проблемные участки: в
околокритической области линии
температур общей и частичной
гомогенизации почти параллельны,
поэтому точка пересечения их
определяется с большой ошибкой. |
Как следует из вышесказанного,
интерпретация данных флюидных включений
невозможна без глубокого понимания фазовых
диаграмм флюидных систем, начиная от чистых
и кончая сложными многокомпонентными
смесями. Большие ограничения накладывает
отсутствие таких данных для многих
фундаментальных систем, моделирующих
природные флюиды. Причина этого -
экспериментальные сложности при работе с
агрессивными флюидными смесями при высоких
параметрах. Поэтому очень большое значение
имеет разрабатываемый в последние полтора
десятилетия метод синтетических флюидных
включений, который дал возможность изучить
такие важные системы как H2O-CO2,
H2O-CO2-NaCl, H2O-CO2-CaCl2,
H2O-KCl-NaCl, H2O-NaCl-CaCl2 и др.
 Метод
охлаждения образца и замораживания
находящихся во включении газов и жидкостей
называется криометрией. Для криометрии
обычно используется жидкий азот, который
подается в кожух рабочей камеры и охлаждает
образец. Пример выпускаемой
промышленностью установки (фирма Linkam Sci. Instr.)
для изучения газово-жидких включений
приведен на рис. В данной конструкции
применяется плоский нагревательный
элемент (до 600° C),
расположенный под образцом. Это позволяет
добиться минимальных температурных
градиентов внутри камеры. Блок в котором
смонтированы нагреватель, термопара и
столик для образца - серебряные. Это
позволяет добиться (за счет большой
теплопроводности серебра) больших
скоростей нагрева и охлаждения (90°
/мин.) и выравнивать температурные
градиенты при быстром нагреве.
Непосредственно к столику (во время
криометрии) подается жидкий азот, что
позволяет охлаждать образец до -180°
C. Отдельно предусмотрена продувка
газообразным азотом камеры и оптических
систем для того, чтобы во время криометрии
на рабочих поверхностях не
конденсировалась влага и не затрудняла
визуальное наблюдение за ходом
эксперимента. Верхнее и нижнее окна сделаны
из кварцевого стекла, окно в нагревателе -
из сапфира. Сапфировое окно необходимо для
нейтрализации (по методу дополнительных
окрасок) света испускаемого нагревательной
спиралью при высоких температурах.
Метод
охлаждения образца и замораживания
находящихся во включении газов и жидкостей
называется криометрией. Для криометрии
обычно используется жидкий азот, который
подается в кожух рабочей камеры и охлаждает
образец. Пример выпускаемой
промышленностью установки (фирма Linkam Sci. Instr.)
для изучения газово-жидких включений
приведен на рис. В данной конструкции
применяется плоский нагревательный
элемент (до 600° C),
расположенный под образцом. Это позволяет
добиться минимальных температурных
градиентов внутри камеры. Блок в котором
смонтированы нагреватель, термопара и
столик для образца - серебряные. Это
позволяет добиться (за счет большой
теплопроводности серебра) больших
скоростей нагрева и охлаждения (90°
/мин.) и выравнивать температурные
градиенты при быстром нагреве.
Непосредственно к столику (во время
криометрии) подается жидкий азот, что
позволяет охлаждать образец до -180°
C. Отдельно предусмотрена продувка
газообразным азотом камеры и оптических
систем для того, чтобы во время криометрии
на рабочих поверхностях не
конденсировалась влага и не затрудняла
визуальное наблюдение за ходом
эксперимента. Верхнее и нижнее окна сделаны
из кварцевого стекла, окно в нагревателе -
из сапфира. Сапфировое окно необходимо для
нейтрализации (по методу дополнительных
окрасок) света испускаемого нагревательной
спиралью при высоких температурах.



 Чем больше концентрация соли, тем круче
угол наклона изохор и тем выше критические
параметры (рис. 139). Было показано, что для
хлоридов металлов 1 и 2 групп наклон изохор
для растворов, с концентрацией меньшей 15масс.%
близок к наклону изохор в системе H2O-NaCl,
и поэтому, а также потому, что P-V-T данные для
для других систем отрывочны или полностью
отсутствуют, при интерпретации измерений
пользуются диаграммами для растворов NaCl.
Очень часто исчезновение газового пузырька
(или жидкой фазы) является последним
фазовым изменением во включении, то есть
включение становится гомогенным. В таком
случае температура гомогенизации является
минимальной температурой образования; и
включение могло быть захвачено на любой
точке вычисленной изохоры.
Чем больше концентрация соли, тем круче
угол наклона изохор и тем выше критические
параметры (рис. 139). Было показано, что для
хлоридов металлов 1 и 2 групп наклон изохор
для растворов, с концентрацией меньшей 15масс.%
близок к наклону изохор в системе H2O-NaCl,
и поэтому, а также потому, что P-V-T данные для
для других систем отрывочны или полностью
отсутствуют, при интерпретации измерений
пользуются диаграммами для растворов NaCl.
Очень часто исчезновение газового пузырька
(или жидкой фазы) является последним
фазовым изменением во включении, то есть
включение становится гомогенным. В таком
случае температура гомогенизации является
минимальной температурой образования; и
включение могло быть захвачено на любой
точке вычисленной изохоры.