6.3. Расчет термодинамических равновесий в системах с газовой фазой
6.3.1. Учет неидеальности газовой фазы
Газовая фаза как идеальная смесь. Наиболее простой способ
описания свойств газовой фазы, очевидно, состоит в том, чтобы представить ее
как идеальный газ. В таком газе химические взаимодействия молекул отсутствуют
(коэффициенты активности тождественно равны 1) и для чистого газообразного
компонента
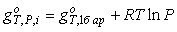 ,(6.9) ,(6.9)
а для
компонента смеси
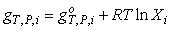 ,(6.10) ,(6.10)
где Xi - мольная доля компонента
в смеси.
Это
"приближение идеального газа" хорошо оправдывается при расчетах свойств
малоплотных газов [Волков, Рузайкин, 1969], однако для гидротермальных условий
оно уже не всегда применимо. При (см.,
например, [Мельник, 1978]), и это приходится учитывать в расчетах. Тогда,
соответственно, уравнение (6.9) должно быть заменено;
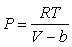 .(6.11) .(6.11)
Совместное
использование уравнений (6.11) и (6.10) дает приближение "идеального раствора
реальных газов" ("правило Льюиса-Рендалла"). Обычно считается, что это
приближение потенциально обладает более широкой областью применимости,
поскольку эффекты неидеальности смешения газообразных компонентов невелики1.
Компьютерные
программы и модели для систем "идеальная газовая фаза - минералы" появились
исторически даже раньше, чем для систем с водной фазой [Волков, Рузайкин,
1969]. Однако область их применимости в геохимии оказалась не очень широкой -
это космохимические модели (см., например, [Ходаковский и др., 1978]) и расчеты
состояния вулканических газов [Symonds et al.,1992; Symonds, Reed, 1993]. При
этом иногда практикуется смешанный вариант модели - для макрокомпонентов (H2O,
CO2) учитываются отклонения летучести от давления, а для малых
компонентов этим отклонением пренебрегают [Bowers, 1991].
Газовая фаза как реальный раствор. Для более точного описания
свойств газовых смесей следует учесть неидеальность смешения. В современной
термодинамике газов для этого используется три основных способа. В первом
способе свойства газов и их смесей (в общем случае - уравнения состояния)
представляются как полиномиальные функции от независимых параметров системы (T, P
или V, Xi). Во втором способе для конструирования уравнений
состояния используются физические модельные приближения, позволяющие связать T, P
и V газов и их смесей (уравнение
Ван-дер-Ваальса и его развитие). В третьем способе - методе молекулярной
динамики используются расчеты на основе модельных потенциалов межмолекулярного
взаимодействия.
Метод
молекулярной динамики, обладающий, по-видимому, наибольшими прогностическими
свойствами, в силу сложности реализации используется в настоящее время для
расчета свойств газов при высоких параметрах состояния. Случаи использования
его в термодинамических моделях гидротермального рудообразования автору не
известны.
Метод
полиномиальных функций использовался многими исследователями. Он неоднократно
применялся для создания уравнений состояния (например, уравнение
Бенедикта-Вебба-Рубина [Рид и др., 1982]). В термодинамических моделях
геохимических процессов этот подход использован в программе CHILLER [Spycher,
Reed, 1988, 1989]. Метод полиномиальных функций обладает наибольшей точностью
при интерполяции совокупностей экспериментальных данных. Однако для
геологически значимых моделей многокомпонентных систем более важны
экстраполяционные свойства как в отношении интенсивных параметров (T, P),
так и компонентного состава систем. В упомянутой выше программе CHILLER газовая
фаза включает всего лишь 5 компонентов, причем неидеальность смешения
учитывается только для H2O, CO2 и CH4. При
этом даже для такой простой газовой смеси оказывается необходимым использование
двумерных и трехмерных матриц перекрестных коэффициентов, каждый из которых в
свою очередь является полиномом от T
и P. Очевидно, что этот путь требует
огромного объема экспериментальных данных, и громоздкость его будет возрастать
как степенная функция от числа компонентов системы. Таким образом, платой за
точность метода оказывается трудность использования в сложных системах.
Метод
уравнений состояния восходит к уравнению Ван-дер-Ваальса, в котором в
дополнение к закону Клапейрона-Менделеева для идеального газа (PV=RT,
где R - газовая постоянная) учтен
"собственный объем" молекул газа:
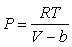 .(6.12) .(6.12)
В 1948 году
это уравнение было усовершенствовано О.Редлихом и Дж.Квонгом:
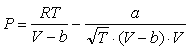 .(6.13) .(6.13)
Коэффициенты a и b,
входящие в это уравнение можно найти, основываясь на принципе соответственных
состояний, из параметров критических точек чистых веществ.
Чрезвычайно
популярное уравнение Редлиха-Квонга затем модифицировалось многими авторами,
как в отношении формы второго слагаемого, так и по методам вычисления
коэффициентов a и b (обзор проблемы - см. [Рид и др.,
1982]). Так, например, в уравнении Соавэ множитель
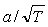 заменен на: заменен на:
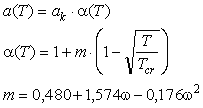
где 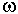 - ацентрический фактор Питцера,
индивидуальный для каждого газа. Модифицированное уравнение Редлиха-Квонга было
использовано при разработке версии программы EQ3/6, предназначенной для расчета
гетерогенных систем с газовой фазой [Bowers, 1991]. - ацентрический фактор Питцера,
индивидуальный для каждого газа. Модифицированное уравнение Редлиха-Квонга было
использовано при разработке версии программы EQ3/6, предназначенной для расчета
гетерогенных систем с газовой фазой [Bowers, 1991].
В 1976 году
Д.Пенгом и Д.Робинсоном [Peng, Robinson, 1976] было предложено дальнейшее
развитие уравнения состояния, обладающее важными свойствами в отношении
описания газовых смесей:
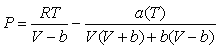 , где(6.14) , где(6.14)
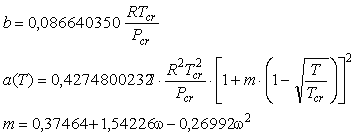
С помощью
уравнения Пенга-Робинсона свойства чистого газа описываются с помощью всего
лишь трех индивидуальных свойств: T и
P критической точки газа и
ацентрического фактора Питцера 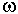 . Эти свойства сейчас
определены для широкого круга веществ, в том числе - для многих геохимически
важных соединений [Рид и др., 1982]. Значения критических параметров и . Эти свойства сейчас
определены для широкого круга веществ, в том числе - для многих геохимически
важных соединений [Рид и др., 1982]. Значения критических параметров и 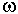 для ряда газов приведены в табл.6.3. для ряда газов приведены в табл.6.3.
Для расчета
газовых смесей Пенгом и Робинсоном были использованы следующие допущения: 1)
свойства смеси газов отождествляются с гипотетическим газом, имеющим T и P
критической точки те же, что и смесь; 2) параметры
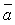 и и 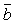 для смеси
являются функциями состава смеси и параметров компонентов состава смеси bi и a(T)i : для смеси
являются функциями состава смеси и параметров компонентов состава смеси bi и a(T)i :
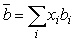 (6.15) (6.15)
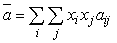 (6.16) (6.16)
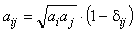 (6.17) (6.17)
где  ij- перекрестный коэффициент ( ij- перекрестный коэффициент ( ij= ij= ji, ji, ii=0
). ii=0
).
Таким образом,
для газовых смесей используется лишь единственная двумерная матрица
коэффициентов  ij. В оригинальной работе [Peng, Robinson, 1976] указано,
что параметры ij. В оригинальной работе [Peng, Robinson, 1976] указано,
что параметры  ij могут быть
приняты не зависящими от температуры. Поэтому уравнение Пенга-Робинсона должно
быть очень сильным в отношении экстраполяции по температуре. В дальнейшем, для
повышения точности расчетов, для некоторых систем были получены температурные
полиномы для величин перекрестного коэффициента.
Величины ij могут быть
приняты не зависящими от температуры. Поэтому уравнение Пенга-Робинсона должно
быть очень сильным в отношении экстраполяции по температуре. В дальнейшем, для
повышения точности расчетов, для некоторых систем были получены температурные
полиномы для величин перекрестного коэффициента.
Величины  ij к настоящему
времени определены для многих пар геохимически важных соединений (табл.6.4). ij к настоящему
времени определены для многих пар геохимически важных соединений (табл.6.4).
Для
использования в программах, рассчитывающих равновесия в изобарно-изотермических
условиях, исходное уравнение (6.14) непригодно, поскольку в нем аргументами
выступают T и V . Поэтому уравнение Пенга-Робинсона, как и другие уравнения "типа
Редлиха-Квонга", должно быть преобразовано заменой переменных в кубическое
уравнение относительно сжимаемости Z
:
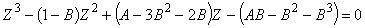 , где(6.18) , где(6.18)
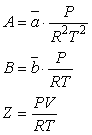
Уравнение
Пенга-Робинсона позволяет вычислить парциальные величины компонентов смеси, из
которых наиболее важны коэффициенты летучести индивидуальных компонентов смеси
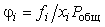 . Преобразованием уравнений (6.15-6.18) в работе [Peng, Robinson,
1976] было получено: . Преобразованием уравнений (6.15-6.18) в работе [Peng, Robinson,
1976] было получено:
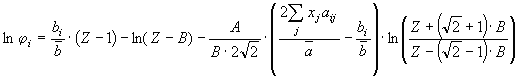 (6.19) (6.19)
где Z, A,
B, 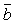 , , 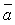 , aij
определены уравнениями (6.18) и (6.15-6.17), соответственно. Таким образом,
коэффициент летучести индивидуального компонента определяется составом и
сжимаемостью газовой смеси (Z),
аддитивными функциями ( , aij
определены уравнениями (6.18) и (6.15-6.17), соответственно. Таким образом,
коэффициент летучести индивидуального компонента определяется составом и
сжимаемостью газовой смеси (Z),
аддитивными функциями (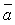 и и
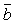 ) свойств чистых компонентов смеси (Tcr,i , Pcr,i и ) свойств чистых компонентов смеси (Tcr,i , Pcr,i и 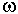 i ), и перекрестными параметрами i ), и перекрестными параметрами  ij>. ij>.
Простота и
малое число эмпирических параметров делают уравнение Пенга-Робинсона весьма
привлекательным для использования в термодинамических моделях многокомпонентных
систем. Компьютерная программа, использующая уравнение Пенга-Робинсона и
ориентированная на решение геохимических задач разработана М.В.Мироненко
[Мироненко, Косоруков, 1990].
Оборотной
стороной простоты уравнения состояния является его меньшая точность по
сравнению с полиномиальными уравнениями. Поэтому вопрос точности описания
свойств газовой фазы должен быть специально проанализирован.
Оценки погрешностей при использовании уравнения
Пенга-Робинсона. Это уравнение, как и другие модельные уравнения, учитывает не все
физические свойства молекул. В него входят, согласно принципу соответственных
состояний, нормированные по критической точке температура (T/Tcr) и
давление (P/Pcr), и ацентрический параметр
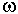 , отражающий отклонение молекул газа от сферической симметрии. Однако в
уравнении не учтены в явной форме возможные диполь-дипольные взаимодействия. Это
приводит к тому, что уравнение Пенга-Робинсона (как и другие уравнения "типа
Редлиха-Квонга") хорошо работает для неполярных газов, и заметно хуже - для
полярных. Из числа последних наиболее геохимически важен водяной пар. , отражающий отклонение молекул газа от сферической симметрии. Однако в
уравнении не учтены в явной форме возможные диполь-дипольные взаимодействия. Это
приводит к тому, что уравнение Пенга-Робинсона (как и другие уравнения "типа
Редлиха-Квонга") хорошо работает для неполярных газов, и заметно хуже - для
полярных. Из числа последних наиболее геохимически важен водяной пар.
Свойства
водяного пара в настоящее время хорошо изучены. Созданы весьма точные модели,
позволяющие рассчитывать его свойства, в том числе модель
Хаара-Галлахера-Келла, используемая в модифицированной модели HKF и в банке
UNITHERM. Это позволяет проверить точность работы уравнения Пенга-Робинсона для
газообразной H2O. В табл.6.5 приведены результаты расчета летучести
H2O вдоль линии кипения чистой воды по модели Хаара-Галлахера-Келла
и уравнению Пенга-Робинсона. Эти результаты показывают, что уравнение
Пенга-Робинсона дает погрешность в летучести водяного пара до 2o/o от
определяемой величины, достигающую наибольших значений при 250oС. Размер
погрешности в энергетическом выражении (в gT(H2Oгаз))
- 30B80 Дж/моль кажется не очень существенным
относительно других источников ошибок в многокомпонентных моделях. Однако
следует учитывать, что газовая фаза в моделях кипения находится в равновесии с
жидкой водой. Полученная в табл.6.5 погрешность эквивалентна смещению кривой
кипения примерно на 1 бар. В расчетах изобарно-изотермических равновесий это
может оказаться довольно неприятно. Очевидный выход из этой коллизии -
использование комбинированного способа, когда для водяного пара при расчете
летучести чистого компонента используется более точная модель
Хаара-Галлахера-Келла, а для других компонентов и для расчета неидеальности
смешения - уравнение Пенга-Робинсона [Japas, Levelt-Sengers, 1989].
Весьма важное
обстоятельство для оценки работоспособности уравнения Пенга-Робинсона - это то,
что H2O характеризуется чрезвычайно сильным диполь-дипольным
взаимодействием. Мерой этого взаимодействия является дипольный момент молекулы
(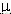 ).
В табл.6.6 приведены величины дипольных моментов молекул для геохимически
важных газов. Из этих данных видно, что дипольный момент молекулы H2O
имеет максимальное значение. Соответственно, эффекты, связанные с
диполь-дипольным взаимодействием у водяного пара гораздо сильнее, чем у других
веществ. Таким образом, погрешности уравнения Пенга-Робинсона, полученные для H2O
представляют собой максимально возможные в моделях природных систем. ).
В табл.6.6 приведены величины дипольных моментов молекул для геохимически
важных газов. Из этих данных видно, что дипольный момент молекулы H2O
имеет максимальное значение. Соответственно, эффекты, связанные с
диполь-дипольным взаимодействием у водяного пара гораздо сильнее, чем у других
веществ. Таким образом, погрешности уравнения Пенга-Робинсона, полученные для H2O
представляют собой максимально возможные в моделях природных систем.
Использованная
в уравнении Пенга-Робинсона (как и в других уравнениях "типа Редлиха-Квонга")
подмена смеси газов гипотетическим газом с аналогичными критическими
параметрами не вполне корректна теоретически (анализ этого вопроса содержится в
работе [Намиот, 1991]), что приводит к тому, что уравнение должно лучше
описывать гомогенную область, чем фазовые границы с жидкостью.
Подробный
анализ точности различных уравнений состояния был проведен в работе [Seitz et
al., 1994] на примере хорошо изученной экспериментально системы CO2-CH4-N2
(200oС, 1000 бар). Было получено, что уравнения Редлиха-Квонга и
Пенга-Робинсона уступают по точности полиномиальным уравнениям. Однако обращает
на себя внимание замечание авторов работы, что основной вклад в погрешность
расчета по уравнениям Редлиха-Квонга и Пенга-Робинсона связан с недостаточно
точным вычислением свойств краевых чистых компонентов, как это обсуждалось выше
на примере H2O. Объемный эффект смешения в рассматривавшейся тройной
системе был очень невелик (< 3o/o от объема смеси), и уравнение
Пенга-Робинсона предсказывало его с погрешностью
45o/o относительных,
сопоставимой с ошибкой для краевых компонентов. Точность уравнения
Пенга-Робинсона оказалась выше, чем для уравнения Редлиха-Квонга. При
использовании для воды точного уравнения (Хаара-Галлахера-Келла) в работе
[Japas, Levelt-Sengers, 1989] удалось с помощью уравнения Пенга-Робинсона
рассчитать составы равновесных газов в бинарных системах с погрешностью около
1o/o по мольной доле газа.
В исходной
работе [Peng, Robinson, 1976] допускается, что величины
 ij не зависят от
температуры. Проведенные детальные исследования системы H2O-H2S
[Roberts, Tremaine, 1985; Carroll, Mather, 1989] показали, что для лучшего
описания свойств этой системы требуется ввести температурную зависимость ij не зависят от
температуры. Проведенные детальные исследования системы H2O-H2S
[Roberts, Tremaine, 1985; Carroll, Mather, 1989] показали, что для лучшего
описания свойств этой системы требуется ввести температурную зависимость
 H2O-H2S. Полученные в этих работах температурные полиномы
приведены в табл.6.4. Из данных Кэррола и Матера следует, что величина H2O-H2S. Полученные в этих работах температурные полиномы
приведены в табл.6.4. Из данных Кэррола и Матера следует, что величина
 ij меняется от
-0,06 при 0oС до +0,08 при 220oС. Это непостоянство ij меняется от
-0,06 при 0oС до +0,08 при 220oС. Это непостоянство
 ij для системы H2O-H2S
в условиях преобладания H2O приводит к изменчивости величины
коэффициента активности H2S в пределах
30o/o, что не превышает другие
погрешности термодинамических моделей многокомпонентных систем. ij для системы H2O-H2S
в условиях преобладания H2O приводит к изменчивости величины
коэффициента активности H2S в пределах
30o/o, что не превышает другие
погрешности термодинамических моделей многокомпонентных систем.
Таким образом, уравнение Пенга-Робинсона может быть использовано в термодинамических
моделях многокомпонентных систем в качестве универсального метода расчета: а)
неидеальности смешения газовых смесей и б) реальных свойств чистых газообразных
веществ, кроме H2O. Погрешности расчета при этом не будут превышать
100 Дж/моль.
|

