6.2.2. Участие бактерий в процессе деструкции сульфидов
За последние десятилетия работами микробиологов установлено, что тионовые бактерии, и в первую очередь микроорганизмы Th. ferrooxidans, принимают участие в окислении сульфидных руд. При этом на первом этапе этих исследований (1950-1960-е годы) была доказана способность Th. ferrooxidans стимулировать в кислом растворе (pH<3) окисление закисного железа согласно реакции 4FeSO4+2H2SO4+O2 2Fe2(SO4)3+2H2O. Принимая эту реакцию в виде основополагающей, микробиологи создали представление о косвенном механизме бактериального окисления сульфидов (Кузнецов и др., 1962; Каравайко и др., 1972), согласно которому окисление минералов рассматривается как химический процесс, осуществляющийся с помощью сульфата трехвалентного железа, а бактериям отводится роль окислителя образующихся в растворе FeSO4 и серы. Так, для пирита этот процесс описывался следующими реакциями:
2Fe2(SO4)3+2H2O. Принимая эту реакцию в виде основополагающей, микробиологи создали представление о косвенном механизме бактериального окисления сульфидов (Кузнецов и др., 1962; Каравайко и др., 1972), согласно которому окисление минералов рассматривается как химический процесс, осуществляющийся с помощью сульфата трехвалентного железа, а бактериям отводится роль окислителя образующихся в растворе FeSO4 и серы. Так, для пирита этот процесс описывался следующими реакциями:
FeS2+3,5O2+H2O=FeSO4+H2SO4 - химическим путем,
2FeSO4+0,5O2+H2SO4=Fe2(SO4)3+H2O - бактериальным путем,
FeS2+Fe2(SO4)3=3FeSO4+2S - химическим путем,
S+1,5O2+H2O=H2SO4 - с помощью бактерий.
На представлениях о косвенной роли бактерий и первостепенном значении сульфата окисного железа базировались и первые промышленные технологии бактериального выщелачивания руд.
В 1960-е годы в Великобритании возникла электрохимическая гипотеза жизнеобеспечения микроорганизмов (работы П. Митчелла), согласно которой трансформация энергии окисления в энергию жизнеобеспечения клетки имеет промежуточную электрическую энергию. Иными словами, процесс окисления вещества связан с биохимическими реакциями в живой клетке потоком (транспортом) электронов с косного (окисляющегося) субстрата на клетку.
В это же время в минералогии интенсивно разрабатывается представление о природном окислении полупроводниковых минералов (сульфидов) как об электрохимическом процессе, сопоставимом с процессом коррозии металлов (работы М. Сато, Р. Гаррелса, Г. Свешникова, Л. Яхонтовой и др.) В чисто химическом варианте осуществление процессов окисления минерала предполагает наличие противоположного процесса восстановления на окислителе, находящемся в электролите (например, на кислороде, ионе Fe3+ и др.) и потребляющем электроны окислительной реакции. В бактериальном варианте таким потребителем электронов может стать живой окислитель - клетка микроорганизма, стимулирующая тем самым процесс окисления минерального субстрата.
С высказанной идеей согласуются данные о прямом контакте микроорганизма с окисляющимся минеральным веществом, которые стали появляться уже в конце 1950-х годов. В частности, было показано прямое воздействие Th. ferrooxidans на ковеллин и халькозин (Bryner, Anderson, 1957; Razzell, Trussell, 1963), а затем на пирит, халькопирит и борнит (Гайдаржиев V., Грудев C., 1972). Прямой контакт тионовых бактерий с сульфидами подтвердился электронно-микроскопическими исследованиями (Berry, Murr, 1976; Пивоварова, 1977). Снимки, полученные в сканирующем микроскопе, продемонстрировали избирательную адсорбцию бактериальных клеток на сульфидной поверхности, а не на поверхности содержащихся в изученных пробах силикатов.
В настоящее время появляется все больше доказательств в пользу электрохимической модели бактериального окисления сульфидов в условиях прямого контакта клетки микроорганизма с минералом. Клетка, благодаря своим окислительным ферментам и катализаторам, стимулирует окислительный процесс на минерале, в результате чего получает необходимую для своего существования и развития энергию. Микроорганизм выступает в роли живого окислителя, а с точки зрения электрохимической модели процесса окисления - живого катода. Минерал, становясь донором электронов для бактериальной клетки, окисляется, т.е. разрушается, занимая в этой системе анодную позицию. На разных минералах, в первую очередь в зависимости от их химической и структурной конституции, этот процесс в отношении его общего характера и интенсивности осуществляется индивидуально.
В настоящее время на основе электрохимической модели экспериментально исследован процесс бактериального окисления ряда сульфидных минералов - халькозина, борнита, халькопирита (Яхонтова, Нестерович, 1978; Яхонтова и др., 1980б), пирита (Яхонтова и др., 1980а), арсенопирита (Яхонтова и др., 1981б), пирротина и пентландита (Яхонтова, Нестерович, 1983).
Опыты проводились с использованием бактерий Th. ferrooxidans в сернокислом растворе (питательная среда 9К*
) pH=2,5-3 в условиях термостатирования препаратов (около +30оС) - культурального (минеральной суспензии с бактериями) и холостого (минеральной суспензии без бактерий). В течение экспериментов (12-14 сут) склянки с растворами в термостате размещались на качалке. В результате постоянного встряхивания растворов происходило перемешивание и, следовательно, улучшение контактирования бактериальных клеток с минеральными частицами. В термостат постоянно подавался воздух. Исходная концентрация Th. ferrooxidans в рабочем объеме (100 мл) минеральной суспензии обычно составляла 105 клеток. После окончания опытов определялась конечная концентрация бактерий, которая служила одним из критериев интенсивности окисления сульфида.
В склянках с культурным и холостым растворами в период эксперимента были размещены периодически подключающиеся к pH-метру минеральные электроды - миниатюрные кусочки мономинерального сульфида с полированной поверхностью, запрессованные в полистироловый цемент. Использованный в экспериментах сульфид предварительно тщательно исследовался минералогически в отношении химического состава, степени однородности, примесей, дефектов, типа проводимости и прочих особенностей.
В ходе эксперимента ежедневно проводилось измерение ЭП сульфида, ОП раствора-суспензии и pH раствора. Через сутки раствор в склянках количественно анализировался на содержание в нем элементов, входящих в состав сульфида. При этом отдельно определялись окись и закись железа, меди и других разновалентных элементов, а также исходное и конечное валовое содержание в растворах сульфатного аниона. В целом бактериальное окисление сульфида в описанных экспериментах изучалось c получением электрохимических (ЭП, ОП, pH), количественных химико-аналитических (состав растворов) и бактериальных (рост и развитие бактерий) параметров, описывающих этот процесс и представляемых в виде графиков и диаграмм.
Следует отметить, что указанным экспериментам обычно предшествует большая дополнительная работа, связанная не только с уже отмеченным исследованием окисляющегося минерала, но и с изучением процесса его химического (абиогенного) окисления и характера растворения в используемых сернокислых растворах с заданной величиной pH. Особое внимание уделяется получению данных по химизму и состоянию этих растворов в координатах Eh-pH, для чего изучается имеющаяся справочная и специальная литература, а иногда проводятся дополнительные эксперименты.
Специальные опыты по изучению абиогенного окисления сульфидов решают важнейшие вопросы, касающиеся, в первую очередь, вывода уравнений окисления минерала в различных областях Eh-pH - состояния раствора, особенно в кислых условиях - в среде развития Th. ferrooxidans, и определения форм, в виде которых компоненты сульфида оказываются в культуральном растворе, когда процесс окисления совершается с участием весьма активного окислителя - бактерий. Подобные исследования проведены для целого ряда сульфидов - пирита, халькопирита, халькозина, галенита, сфалерита, арсенопирита, станнина, пентландита, тетраэдрита и др. С их результатами можно познакомиться в уже указанных публикациях.
Так, в случае экспериментального изучения окисления халькозина предварительно (также опытным путем) было определено, что в сернокислой среде с pH<3 халькозин окисляется в соответствии с реакцией Cu2S+1,75O2+0,5H2O [CuHSO4]++Cu2++3
[CuHSO4]++Cu2++3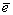 . Образование комплексного катиона [CuHSO4]+ приводит к ощутимому повышению pH раствора, что хотя и снижает возможность дальнейшего формирования этого комплекса, но становится губительным для клеток Th. ferrooxidans. В связи с этим в ходе эксперимента приходилось регулировать величину pH раствора путем добавления определенного объема серной кислоты. . Образование комплексного катиона [CuHSO4]+ приводит к ощутимому повышению pH раствора, что хотя и снижает возможность дальнейшего формирования этого комплекса, но становится губительным для клеток Th. ferrooxidans. В связи с этим в ходе эксперимента приходилось регулировать величину pH раствора путем добавления определенного объема серной кислоты.
В результате было установлено наиболее интенсивное выщелачивание из сульфида меди (за 12 сут было извлечено около 15% Cu), существенно опережающее выход в раствор серы: в бактериальном процессе действовал механизм экстракции металла. Деструкция минерала осуществлялась в условиях проявления основного правила: ОП культурного раствора был постоянно выше ЭП сульфида. По окончании эксперимента концентрация Th. ferrooxidans в растворе оказалась 109кл/мл, что в 1000 раз превысило исходное содержание "живого вещества".
Экстрагирование меди из халькозина практически происходило в течение 6 сут эксперимента. Торможение и затем прекращение окисления частиц минерала, скорее всего, связано с интенсивным изменением их поверхности, благодаря потере кристаллической решеткой катионных узлов и возникшим затруднениям с выходом электронов с измененной поверхности сульфида. В практике выщелачивания меди в подобных случаях производится передробление или перетирание руды.
Один из основных выводов рассмотренного исследования заключается в том, что процесс бактериального выщелачивания металла из минерала оказалось возможным контролировать измерением или анализом ОП среды и ЭП сульфида - конец экстрагирования меди регистрируется выходом обоих графиков на стабильную позицию. Обратный характер изменения ОП (снижение) и ЭП (возрастание) в начале опыта связан с постоянным падением концентрации свободных ионов H+ в растворе и накоплением продуктов окислительной реакции, т.е. с выходом меди в раствор.
Процесс окисления сульфидов существенно усложняется, когда они образуют полиминеральные ассоциации - руды. Окисление руд направляется и контролируется особенностями электрохимических реакций, протекающих между контактирующими минералами и участвующими в этом процессе микроорганизмами.
В настоящее время имеются данные по бактериальному окислению простейших рудных ассоциаций - сульфидных пар, в частности тех, которые характерны для лучше обследованных микробиологами медноколчеданных месторождений. В связи с уже рассмотренным примером окисления халькозина наиболее интересным представляется опыт по бактериальному окислению пары халькозин-пирит (весовое отношение минералов в смеси равно 1). Результаты эксперимента показывают, что в течение опыта пирит по отношению к халькозину занимает устойчивую катодную позицию (его ЭП был постоянно выше ЭП халькозина). В данном случае было как бы два катода - пирит и микроорганизм Th. ferrooxidans, оба стимулировавшие процесс окисления халькозина. В результате выход меди в раствор резко увеличился и за 8 сут. составил 50% от содержания этого металла в минерале. В табл. 48 приведены результаты и других экспериментов с двойными смесями сульфидов. Во всех случаях добавка высокопотенциального ("катодного") сульфида способствовала интенсификации окисления другого минерала смеси, находившегося в анодном положении.
Таблица 48
Выход меди в раствор в опытах с мономинеральными и смешанными пробами за 8 сут. (в % от содержания Cu в 1 г пробы сульфида)
|
Мономинеральные пробы |
Выход меди |
Смешанные пробы |
Выход меди |
|
Халькозин
Халькопирит
Борнит |
12
25
30 |
Халькозин-пирит
Халькопирит-пирит
Борнит-пирит
Халькозин-халькопирит |
50
60
50
50 |
Результаты, полученные на основании имеющихся экспериментов по бактериальному окислению сульфидов, позволяют сделать следующие выводы:
1. Окисление сульфидных минералов с помощью бактерий происходит по законам электродных (коррозионных) процессов, в которых сульфид-донор занимает по отношению к бактериальным клеткам анодное положение;
2. Бактериальное окисление сульфидов ощутимо интенсифицируется, когда минералы образуют смеси друг с другом. В смесях (полиминеральных рудах) минерал, обладающий более высоким электродным потенциалом, наряду с бактериальными клетками выполняет роль дополнительного катода, усиливающего процесс окисления низкопотенциального минерала;
3. В практике бактериального выщелачивания сульфидных руд следует учитывать минеральный тип руды, наличие в ее составе высокопотенциальных минералов и характер сочетаний их друг с другом. В случае нехватки в составе руды "катодных" сульфидов (например, пирита) можно рекомендовать их специальную добавку, увеличивающую выход металла в раствор;
4. Одна из важнейших проблем, связанных с бактериальной деструкцией
сульфидов, а также с организацией и развитием биотехнологии, заключается в
выявлении тонкой химико-структурной конструкции минералов на этот процесс.
Использование общих соображений, опирающихся на структурную модель сульфидного
минерала (например, кластерная позиция некоторых атомов в структуре - Fe в
пирротине, Ni - в пентландите; тип проводимости в случае пирита или арсенопирита
и др.) или на расчетные данные (величина Еа, ЭхП, эффективные заряды и пр.)
для прогноза результатов бактериальной деструкции минерала, может иметь только
общее, прикидочное значение. В каждом конкретном случае необходима большая
исследовательская работа, выполняемая на высоком методическом уровне.
|

