|
|
Пивоваров Сергей Анатольевич
Автореферат диссертации на соискание ученой степени кандидата химических
наук |
содержание >> |
Глава 4. Модель взаимодействия ионов
с (гидр)оксидами железа (III)
Окислы трехвалентного железа
являются сильнейшими адсорбентами тяжелых металлов. Свободные окислы железа
в почвах и грунтах обычно представлены смесью ферригидрита (аморфный FeOOH),
гетита ( -FeOOH) и гематита ( -FeOOH) и гематита ( -Fe2O3). Их сорбционная
емкость зависит от удельной поверхности,
которая составляет, в среднем, около 60 м2/г почвенного FeOOH. По
оценке Дэвиса (Davis, 1977), удельная поверхность свежеосажденного ферригидрита
составляет около 600 м2/г FeOOH. Обычно предполагается, что содержание
"подвижного" железа (извлекаемого кислыми растворами оксалата натрия)
в природных грунтах соответствует содержанию ферригидрита. -Fe2O3). Их сорбционная
емкость зависит от удельной поверхности,
которая составляет, в среднем, около 60 м2/г почвенного FeOOH. По
оценке Дэвиса (Davis, 1977), удельная поверхность свежеосажденного ферригидрита
составляет около 600 м2/г FeOOH. Обычно предполагается, что содержание
"подвижного" железа (извлекаемого кислыми растворами оксалата натрия)
в природных грунтах соответствует содержанию ферригидрита.
 |
| Рис. 3. Модель поверхности гематита |
На рис. 3 показана модель поверхности гематита
(грань 001 в верхней части рисунка и грань 101 в нижней), предложенная автором.
Поверхность гематита содержит 6.9-7.6 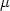 моль/м2 адсорбционных центров
(>FeOH групп). Поверхность гематита имеет амфотерные свойства и может адсорбировать
протоны и гидроксил-ионы. Качественными отличиями модели, развитой в настоящей
работе, являются использование уравнения баланса заряда (т.е. поверхность в
целом электрически нейтральна) и введение в уравнения связи реакции самоионизации
поверхности (аналог реакции диссоциации воды в растворе). Для вычисления коэффициентов
активности компонентов на поверхности использована расширенная модель двойного
электрического слоя (ДЭС) постоянной емкости. В отличие от обычной модели ДЭС
постоянной емкости, в ней учтено, что различные противоионы (Na, Ca, Cl, SO4)
подходят на разное расстояние к поверхности и по-разному экранируют ее заряд.
Поэтому значение удельной электрической емкости меняется в зависимости
от состава раствора. моль/м2 адсорбционных центров
(>FeOH групп). Поверхность гематита имеет амфотерные свойства и может адсорбировать
протоны и гидроксил-ионы. Качественными отличиями модели, развитой в настоящей
работе, являются использование уравнения баланса заряда (т.е. поверхность в
целом электрически нейтральна) и введение в уравнения связи реакции самоионизации
поверхности (аналог реакции диссоциации воды в растворе). Для вычисления коэффициентов
активности компонентов на поверхности использована расширенная модель двойного
электрического слоя (ДЭС) постоянной емкости. В отличие от обычной модели ДЭС
постоянной емкости, в ней учтено, что различные противоионы (Na, Ca, Cl, SO4)
подходят на разное расстояние к поверхности и по-разному экранируют ее заряд.
Поэтому значение удельной электрической емкости меняется в зависимости
от состава раствора.
 |
Рис. 4. Кривые титрования гематита.
Данные автора. |
На рис. 4 показаны кривые титрования поверхности гематита. Заметно, что кривые
поглощения кислоты (при рН менее 8) имеют более пологий наклон, чем кривые поглощения
щелочи (при рН более 8). Это как раз и можно связывать с различием ионных радиусов
ионов хлора и натрия. Следует также отметить насыщение поверхности протонами
при рН более 3 (протонируется лишь половина адсорбционных центров, остальные
оказываются занятыми противоионами Cl-).

 |
| Рис. 5. Содержание ионов на поверхности гематита в речной (верхняя
панель) и морской (нижняя панель) воде. |
На рис. 5 показана
"заселенность" поверхности (гидр)оксида железа (III) ионами в речной
и морской воде. Для простоты обозначения поверх-ностных групп сокращены.
Одновалентные противоионы практически полностью
вытесняются с поверхности двухвалентными. В кислой области на поверхности сорбируется
серная кислота (>FeOHSO42- .2>FeOH2+),
а в щелочной наблюдается сорбция карбонатов кальция и магния (>FeOH(Ca,Mg)2+
. FeOHCO32-).
Интересно, что сорбция анионов приводит к эквивалентному
увеличению сорбции катионов, несмотря на конкуренцию за сорбционные места. В целом
адсорбционный слой ведет себя подобно двумерному ионному кристаллу.

 |
| Рис. 6. Адсорбция кадмия на гематите (верхняя панель) и влияние
углекислоты на адсорбцию кадмия (нижняя панель). |
На рис. 6 (верхняя
панель) показаны данные по адсорбции кадмия
на поверхности гематита при различных соотношениях концентрации кадмия и гематита
в суспензии. Адсорбция кадмия сильно увеличивается с ростом рН. Кроме того,
заметно, что при высокой плотности адсорбции кривые адсорбции сильно выполаживаются.
На нижней панели рис. 6 показано, как увеличивается адсорбция кадмия в присутствии
углекислоты. Этот эффект связан исключительно со взаимной компенсацией зарядов
ионов Cd2+ и CO32- на поверхности гематита.
 |
| Рис. 7. Адсорбция цинка, меди и кадмия на аморфной гидроокиси железа
с удельной поверхностью около 600 м2/г. Данные (Benjamin and
Leckie, 1981). |
На рис. 7 показаны данные
по сорбции тяжелых металлов на аморфной гидроокиси железа. Сорбция в ряду Cd
- Zn - Cu увеличивается как 1 : 5 : 200, что говорит о химическом характере
связи металла с поверхностью. Также стоит отметить, что сорбция тяжелых металлов,
отнесенная к метру квадратному поверхности, практически одинакова для гематита
и аморфной гидроокиси кривые для адсорбции кадмия на рис. 6 и 7 проведены с
помощью одних и тех же модельных параметров).
|

