4.1. Результаты моделирования нисходящей ветви конвективной системы
4.1.1. Модель короткоживущей гидротермальной системы
Рассмотрим
вначале результаты расчета взаимодействия морской воды со свежими базальтами,
то есть вариант модели ("первая волна"), который должен соответствовать
начальным этапам действия гидротермальной системы, либо короткоживущим
системам. Пример такого расчета показан на рис.4.1.
Метасоматические минеральные ассоциации зависят
в модели от температуры и количества породы, с которой успел прореагировать
раствор. При малых П/В и низких Т по
базальтам развивается характерная метасоматическая минеральная ассоциация I:
кварц + хлорит + гематит + ангидрит ` каолинит ` тальк. При этом из раствора
связывается Mg (в хлорит), железо и сера базальтов окисляются растворенным
кислородом морской воды. Большинство компонентов базальтов (кроме Al, Fe, Si,
Mg) извлекается раствором. Переход Ca из породы в воду вызывает осаждение
ангидрита.
Повышение Т и связанная с этим интенсификация
взаимодействия с породой (т.е. рост П/В - рис 4.1а) приводят к изменению метасоматической ассоциации. В варианте
расчета, показанном на рис.4.1б, при Т > 230oС и П/В > 0,027 базальт
преобразуется в ассоциацию II: хлорит + эпидот + актинолит ` кварц ` сульфиды. С П/В > 0,06 к
ассоциации добавляется альбит. До температур 260-290o в этой ассоциации
устойчив также пумпеллиит. В области II ассоциации раствор становится
восстановленным и содержит существенные количества Н2S и H2.
Формирование I и II ассоциаций - устойчивая характеристика модели, и, как
будет показано ниже, смена их вызывает изменение состава раствора и поведения
рудных элементов.
Поскольку
переход от I ассоциации ко II имеет важное значение, следует определить, какой
из факторов - температура или отношение П/В определяет положение перехода. Для
этого была выполнена серия расчетов, в которой достигались различные значения  П/В
(при 400o)в диапазоне от 0,02 до 12 кг/кг. В координатах П/В
(при 400o)в диапазоне от 0,02 до 12 кг/кг. В координатах  П/В
vs Т траектории этих расчетов дают серию субпараллельных кривых -
рис.4.2а, а точки - ступени реакторов
с одинаковыми минеральными ассоциациями образуют связанные области. На этом
рисунке хорошо видно, что положение границы между областями устойчивости I и II
ассоциаций, фиксируемой по появлению в минеральной ассоциации эпидота, почти
полностью зависит от П/В и находится в интервале =0,02-0,03. Существует лишь
очень слабая зависимость положения границы от температуры. Она имеет две
причины: (а) изменение термодинамических свойств участвующих веществ (при
пониженных Т во II ассоциации
присутствуют пумпеллиит + кварц - рис.4.2в,
при высоких Т пумпеллиит исчезает),
(б) предшествующую историю раствора - растворы, достигающие П/В
vs Т траектории этих расчетов дают серию субпараллельных кривых -
рис.4.2а, а точки - ступени реакторов
с одинаковыми минеральными ассоциациями образуют связанные области. На этом
рисунке хорошо видно, что положение границы между областями устойчивости I и II
ассоциаций, фиксируемой по появлению в минеральной ассоциации эпидота, почти
полностью зависит от П/В и находится в интервале =0,02-0,03. Существует лишь
очень слабая зависимость положения границы от температуры. Она имеет две
причины: (а) изменение термодинамических свойств участвующих веществ (при
пониженных Т во II ассоциации
присутствуют пумпеллиит + кварц - рис.4.2в,
при высоких Т пумпеллиит исчезает),
(б) предшествующую историю раствора - растворы, достигающие  П/В
=0,03 при высоких температурах, успевают потерять по
мере нагрева значительную часть П/В
=0,03 при высоких температурах, успевают потерять по
мере нагрева значительную часть  в виде ангидрита. в виде ангидрита.
При детальном
анализе результатов моделирования оказалось, что переход от I ассоциации ко II
происходит не непосредственно, а через промежуточные минеральные ассоциации
(рис.4.2б), в состав которых входят в
разных сочетаниях тремолит, хлорит, кварц, гематит и некоторые алюмосиликаты,
характерные только для этой переходной области - серицит и пирофиллит.
Реалистичность таких промежуточных ассоциаций не вполне ясна. Доля этих
алюмосиликатов невелика, и появление их может быть связано с тем, что в модели
в составе породообразующих минералов актинолита и хлорита не учтены сильно
глиноземистые миналы. При появлении в составе II ассоциации альбита или
пумпеллиита эти фазы исчезают, и интервал значений П/В для появления
промежуточных ассоциаций составляет всего от 0,025 до 0,04 (см.рис.4.2б,в).
На результаты расчета состава растворов эти промежуточные ассоциации не
оказывают какого-либо специфического влияния.
Сульфидные
минералы в нисходящей ветви устойчивы только в пределах II минеральной
ассоциации (см.рис.4.2а). При малых
П/В сульфиды растворяются и частично окисляются. В области II ассоциации поля
устойчивости сульфидных минералов различны. Наименьшее поле имеют сульфиды
железа - пирит устойчив только до температуры 250-270o, а пирротин присутствует
в минеральной ассоциации при более высокой температуре и П/В > 0,3. Сфалерит
и галенит при низких температурах устойчивы при П/В > 0,03, но выше 300o их
поля сокращаются, сдвигаясь к более высоким П/В. В наибольшей степени области
II ассоциации соответствует устойчивость сульфидов меди. При этом на больших
П/В в породе образуется рассеянный халькопирит, а вблизи границы - борнит. В
переходных ассоциациях медь, как правило находится в форме халькозина. Эти
особенности показывают, что в метасоматизированных базальтах сульфидные
минералы присутствуют только при восстановительных условиях среды. Различия
полей их существования связаны в первую очередь с разницей в температурных
зависимостях растворимостей сульфидов металлов. Небольшая область устойчивости
пирротина - главного носителя серы в свежих базальтах указывает на быструю
мобилизацию магматической серы при воздействии гидротермальных растворов, что
действительно отмечается в базальтах океанского дна [Gitlin, 1985].
Макрокомпоненты гидротермальных растворов. Составы гидротермальных
растворов, равновесные с I минеральной ассоциацией сохраняют в основном
сходство с источником - морской водой. Они имеют околонейтральные
кислотно-щелочную и окислительно-восстановительную реакции, содержание Мg в них
выше, чем Ca и К, а  - второй по
концентрации анион (после Cl-. При переходе в область устойчивости II ассоциации
гидротермальные растворы резко меняют свой химический состав. В
высокотемпературной части системы они практически лишены Mg и - второй по
концентрации анион (после Cl-. При переходе в область устойчивости II ассоциации
гидротермальные растворы резко меняют свой химический состав. В
высокотемпературной части системы они практически лишены Mg и
 , и обогащаются Ca, K, Si, Fe и H2S (см.рис.4.1в). Некоторые характерные составы
гидротермальных растворов, полученные в различных вариантах модели, приведены в
табл.4.1. Эти результаты в целом соответствуют ранее опубликованным версиям
данной модели [Гричук и др., 1985; Гидротермальные сульфидные руды , 1992]. , и обогащаются Ca, K, Si, Fe и H2S (см.рис.4.1в). Некоторые характерные составы
гидротермальных растворов, полученные в различных вариантах модели, приведены в
табл.4.1. Эти результаты в целом соответствуют ранее опубликованным версиям
данной модели [Гричук и др., 1985; Гидротермальные сульфидные руды , 1992].
По
особенностям поведения в системе компоненты раствора можно разделить на четыре
группы: 1) присутствующие главным образом в жидкой фазе - Cl, Na, K и H2O;
2) компоненты, присутствующие в основном в твердой фазе, поведение которых
определяется в растворимостью породообразующих метасоматических минералов - Mg,
Ca, Fe, Al, Si, H+ и OH-; 3) компоненты, поведение которых определяется
окислительно-восстановительными реакциям - C, S и H2; 4)
микроэлементы - халькофильные металлы, поведение которых зависит от режима серы
- Cu, Zn и Pb.
Хлор ведет себя в растворе консервативно, концентрация
его незначительно возрастает только при высоких П/В из-за связывания воды
породой. Главная форма нахождения его - свободный ион
Cl-, и в меньшем количестве - комплексные формы
NaCl0,  , а при высоких температурах - также
HCl0. , а при высоких температурах - также
HCl0.
Натрий при взаимодействии воды с базальтом в пределах
устойчивости I минеральной ассоциации полностью переходит в раствор. В
переходной области при невысоких температурах, когда в системе появляется
серицит, а после достижения П/В = 0,06 (при всех Т) - альбит, концентрация Na перестает
расти. При более высоких П/В она постепенно снижается (в основном, за счет
обмена на Ca - см.табл.4.1, растворы N 5-7). Главные формы нахождения в
растворе - Na+,  и
NaCl0. и
NaCl0.
Калий почти во всем диапазоне условий извлекается из
твердой фазы и весьма существенно накапливается в растворе. Его
концентрирование ограничивается при высоких Т
и П/В > 2 появлением микроклина (см.табл.4.1, растворы N 6-7). Калий также
частично задерживается в переходной области в виде серицита. Преобладающая
форма в растворе при низких температурах -
K+, при высоких - в сопоставимых концентрациях присутствует
также KCl0.
Вода захватывается вторичными минералами при
взаимодействии с базальтами. При образовании I метасоматической ассоциации
связывание воды достигает 8-12o/o от массы метасоматитов. Образование II
метасоматической ассоциации сопровождается гораздо более слабой гидратацией -
примерно на 2,5-3o/o по массе, поскольку входящие в нее эпидот и актинолит
содержат мало гидроксильных групп. Тем не менее при взаимодействии с большим
количеством породы (около 34 кг на кг раствора) раствор может быть полностью
исчерпан1. При типичных для океанских гидротерм величинах П/В 0,5-2
связывание воды составляет около 3o/o.
Магний интенсивно извлекается из раствора во всем диапазоне
условий модели. В области устойчивости I ассоциации он переходит в хлорит
(клинохлор) и тальк, а во II и переходных ассоциациях - в актинолит. Остаточные
его концентрации, устанавливающиеся в равновесии со II минеральной ассоциацией
составляют 10-5-10-7 моль/кг (против 53,2 ммоль/в морской
воде). До этого момента падение концентрации магния в растворе примерно
пропорционально росту П/В. Основная форма магния в растворе -
Mg2+, при малых П/В присутствует также  . .
Кальций обладает более сложным поведением в гидротермальной
системе, вследствие чего в координатах  П/В vs Т
его концентрации дают весьма замысловатую картину (а). При низких П/В кальций извлекается из базальтов, и его место в
метасоматических минералах занимается магнием. Переходящий в раствор Ca тотчас
осаждается в виде ангидрита, вследствие чего остаточная концентрация кальция в
растворе несколько снижается (см.рис.4.1в).
Масштабы этого снижения больше при высоких температурах из-за того, что
растворимость ангидрита имеет отрицательную температурную зависимость.
Вследствие того, что запас сульфатов в гидротермальном растворе ограничен
(морская вода содержит его 28,2 ммоль/кг), при П/В > 0,01 концентрации Са и П/В vs Т
его концентрации дают весьма замысловатую картину (а). При низких П/В кальций извлекается из базальтов, и его место в
метасоматических минералах занимается магнием. Переходящий в раствор Ca тотчас
осаждается в виде ангидрита, вследствие чего остаточная концентрация кальция в
растворе несколько снижается (см.рис.4.1в).
Масштабы этого снижения больше при высоких температурах из-за того, что
растворимость ангидрита имеет отрицательную температурную зависимость.
Вследствие того, что запас сульфатов в гидротермальном растворе ограничен
(морская вода содержит его 28,2 ммоль/кг), при П/В > 0,01 концентрации Са и
 сравниваются, и затем
содержание Са начинает расти. В равновесии с переходными ассоциациями оно
достигает локального максимума (фиксируемого по моменту исчезновения
ангидрита), после чего снижается вплоть до появления в минеральной ассоциации
альбита. С этого момента снова начинается постепенный рост концентрации
кальция, обусловленный в первую очередь его комплексообразованием -
образованием при высоких температурах комлекса сравниваются, и затем
содержание Са начинает расти. В равновесии с переходными ассоциациями оно
достигает локального максимума (фиксируемого по моменту исчезновения
ангидрита), после чего снижается вплоть до появления в минеральной ассоциации
альбита. С этого момента снова начинается постепенный рост концентрации
кальция, обусловленный в первую очередь его комплексообразованием -
образованием при высоких температурах комлекса
 . Эта форма преобладает в высокотемпературной части системы,
тогда как в низкотемпературной - главная форма - это
Ca2+, и подчиненные - . Эта форма преобладает в высокотемпературной части системы,
тогда как в низкотемпературной - главная форма - это
Ca2+, и подчиненные -  и
CaCl+. При температурах 370-400oС содержания Ca в гидротермальных
растворах в 3-8 раз превышают содержание в исходной морской воде2. и
CaCl+. При температурах 370-400oС содержания Ca в гидротермальных
растворах в 3-8 раз превышают содержание в исходной морской воде2.
Кремнезем почти во всем диапазоне концентраций постепенно
извлекается из базальтов и переходит в раствор. Его концентрация плавно
возрастает с температурой, достигая в горячей части системы 10-15 ммоль/кг.
Отметим, что при высоких П/В кварц отсутствует в минеральной ассоциации, и по
кварцу гидротермальные растворы не насыщены. Аналогичные выводы были сделаны в
работе [Wells, Ghiorso, 1991] на основе экспериментальных данных и изучения
природных прототипов.
Алюминий обнаруживает в гидротермальных системах инертное
поведение, он прочно связан в алюмосиликаты (хлорит, эпидот, альбит) и не
переходит в раствор. Концентрация его составляет в низкотемпературной части
системы nw10-6 моль, при
этом преобладающая форма -  . В высокотемпературной части она растет до n . В высокотемпературной части она растет до n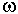 10-5, при этом в
растворе увеличивается доля 10-5, при этом в
растворе увеличивается доля  . .
Железо, если рассматривать систему базальт-морская вода в
целом, характеризуется довольно низкой миграционной способностью, которая
улучшается при повышенных температурах вследствие усиления
комплексообразования, в первую очередь - с хлорид-ионом. В то же время оно
обладает заметно различным поведение в равновесии I и II минеральными
ассоциациями (см.рис.4.3б). При
низких П/В, когда носителями железа являются гематит (FeIII) и
железо-магнезиальный хлорит (FeII) (см.рис.4.1б,
4.2а), раствор
постепенно обогащается железом (до 0,3 ммоль/кг при 200oС и  П/В
= 0,015, и 3,5 ммоль/кг при 300oС и П/В
= 0,015, и 3,5 ммоль/кг при 300oС и  П/В = 0,017 -
см.табл.4.1, N1). В области II минеральной ассоциации в равновесии с железистым
хлоритом, эпидотом и актинолитом концентрация его в растворе резко снижается, и
в диапазоне температур до 280oС железо практически неподвижно. Концентрация Fe
в растворе повышается только при достижении Т
более 350oС за счет интенсификации комплексообразования, и составляет в
околокритических условиях 3-12 ммоль/кг (см.табл.4.1, N 5-7,
рис.4.1в, рис.4.3б). Во всем интервале условий в растворе преобладает FeII,
образующее при низких температурах формы Fe2+ и П/В = 0,017 -
см.табл.4.1, N1). В области II минеральной ассоциации в равновесии с железистым
хлоритом, эпидотом и актинолитом концентрация его в растворе резко снижается, и
в диапазоне температур до 280oС железо практически неподвижно. Концентрация Fe
в растворе повышается только при достижении Т
более 350oС за счет интенсификации комплексообразования, и составляет в
околокритических условиях 3-12 ммоль/кг (см.табл.4.1, N 5-7,
рис.4.1в, рис.4.3б). Во всем интервале условий в растворе преобладает FeII,
образующее при низких температурах формы Fe2+ и
 , а при высоких - , а при высоких -
 и FeOHCl0 (рис.4.4а). Доля комплексных форм FeIII
исчезающе мала во всем изученном диапазоне условий. и FeOHCl0 (рис.4.4а). Доля комплексных форм FeIII
исчезающе мала во всем изученном диапазоне условий.
Сера. Поведение серы в растворе сложно из-за
существования у нее двух валентных форм с высокой миграционной способностью и
сильно различающимися свойствами - сульфата и сероводорода. В исходной морской
воде нет Н2S и содержится 28 ммоль/кг
 . Судьба сульфат-иона в низкотемпературной части системы
определяется двумя факторами: (а) при повышении температуры морская вода
достигает насыщения по ангидриту, растворимость которого имеет отрицательную
температурную зависимость (до =300oС), (б) извлекаемый из базальтов при
взаимодействии их с раствором Ca дополнительно усиливает осаждение ангидрита.
Совместное действие этих двух факторов приводит к значительному удалению
сульфат-иона из раствора - в варианте, показанном на
рис.4.1в при Т = 220oС и П/В = 0,02 в нем остается только 1,07 ммоль/кг сульфат-иона,
т.е. 4o/o от начальной концентрации. В вариантах, где П/В = 0,02 достигается при
более высоких температурах содержания . Судьба сульфат-иона в низкотемпературной части системы
определяется двумя факторами: (а) при повышении температуры морская вода
достигает насыщения по ангидриту, растворимость которого имеет отрицательную
температурную зависимость (до =300oС), (б) извлекаемый из базальтов при
взаимодействии их с раствором Ca дополнительно усиливает осаждение ангидрита.
Совместное действие этих двух факторов приводит к значительному удалению
сульфат-иона из раствора - в варианте, показанном на
рис.4.1в при Т = 220oС и П/В = 0,02 в нем остается только 1,07 ммоль/кг сульфат-иона,
т.е. 4o/o от начальной концентрации. В вариантах, где П/В = 0,02 достигается при
более высоких температурах содержания
 еще ниже (см.рис.4.3в). Присутствующая в исходном базальте SII
в этой части нисходящей ветви полностью извлекается раствором и окисляется до еще ниже (см.рис.4.3в). Присутствующая в исходном базальте SII
в этой части нисходящей ветви полностью извлекается раствором и окисляется до
 . В растворе равновесная концентрация Н2S не
превышает 10-5 ммоль/кг. . В растворе равновесная концентрация Н2S не
превышает 10-5 ммоль/кг.
Резкое
изменение поведения серы происходит при переходе ко II ассоциации. Образование
из вещества базальта минерального буфера эпидот-железистый хлорит вызывает
восстановление
 , из твердой фазы исчезает ангидрит (см.рис.4.2б), а содержание , из твердой фазы исчезает ангидрит (см.рис.4.2б), а содержание
 в растворе падает
практически до нуля. В растворе возрастает содержание Н2S
(см.рис.4.3г), как за счет
восстановления сульфата, так и за счет большей мобилизации SII из
базальтов с ростом П/В. Насыщение раствора относительно исходных "магматических"
сульфидов достигается при Т > 270oС и П/В > 1, когда в ассоциации
минералов появляется FeS - модельный аналог пирротина (см.рис.4.2а). Концентрация Н2S в
растворе при этом возрастает до 10-20 ммоль/кг (см.табл.4.1), в основном за
счет серы породы, как это следует из изотопной модели (см.главу
5). В
результате, в отличие от Fe, для которого в пределах устойчивости II
минеральной ассоциации концентрация в растворе зависит исключительно от
температуры, концентрация SII зависит также и от в растворе падает
практически до нуля. В растворе возрастает содержание Н2S
(см.рис.4.3г), как за счет
восстановления сульфата, так и за счет большей мобилизации SII из
базальтов с ростом П/В. Насыщение раствора относительно исходных "магматических"
сульфидов достигается при Т > 270oС и П/В > 1, когда в ассоциации
минералов появляется FeS - модельный аналог пирротина (см.рис.4.2а). Концентрация Н2S в
растворе при этом возрастает до 10-20 ммоль/кг (см.табл.4.1), в основном за
счет серы породы, как это следует из изотопной модели (см.главу
5). В
результате, в отличие от Fe, для которого в пределах устойчивости II
минеральной ассоциации концентрация в растворе зависит исключительно от
температуры, концентрация SII зависит также и от  П/В
(см.рис.4.3г). Вследствие этого
соотношение в растворе между сульфидной серой и железом меняется в зависимости
от T и П/В
(см.рис.4.3г). Вследствие этого
соотношение в растворе между сульфидной серой и железом меняется в зависимости
от T и  П/В
(см.рис.4.3д) - железо преобладает
над серой при малых П/В и при высоких Т
(> 370oС). Эти особенности поведения серы, как будет показано далее,
отражаются на судьбе других рудных элементов. П/В
(см.рис.4.3д) - железо преобладает
над серой при малых П/В и при высоких Т
(> 370oС). Эти особенности поведения серы, как будет показано далее,
отражаются на судьбе других рудных элементов.
Во всем
диапазоне изученных условий SII мигрирует преимущественно в форме H2S0aq
. Для SVI в начале нисходящей ветви конвекции, когда раствор
похож на исходную морскую воду, преобладает
 . По мере связывания Mg породой возрастает роль . По мере связывания Mg породой возрастает роль
 и и  (см.рис.4.4), а в
области повышенных температур главной формой становится (см.рис.4.4), а в
области повышенных температур главной формой становится
 . .
Углерод не образует минеральных фаз почти во всем диапазоне
исследованных условий. Только при очень высоких П/В (>1 кг/кг) и низких Т в модельной ассоциации минералов
получен кальцит. В области существования I минеральной ассоциации и переходных
ассоциаций главная форма углерода - это  . Доля ее во всем диапазоне условий составляет
2 1 ммоль/кг. При возрастании
восстановленности системы в растворе появляется метан, и концентрация его при
высоких отношениях П/В достигает n
ммоль/кг. В исходном модельном составе базальтов задано небольшое количество
углерода (0,0088 моль/кг - табл.3.15), поэтому суммарное содержание С в
растворах при взаимодействии с породой возрастает. Хотя при расчете баланса
окислительного состояния базальтов углерод задавался в виде СО2,
прирост его содержания происходит в основном за счет метана. Это не вполне
соответствует данным по океанским гидротермам, где в растворенных газах СО2
преобладает над СН4 (см.табл.3.4,
3.7). . Доля ее во всем диапазоне условий составляет
2 1 ммоль/кг. При возрастании
восстановленности системы в растворе появляется метан, и концентрация его при
высоких отношениях П/В достигает n
ммоль/кг. В исходном модельном составе базальтов задано небольшое количество
углерода (0,0088 моль/кг - табл.3.15), поэтому суммарное содержание С в
растворах при взаимодействии с породой возрастает. Хотя при расчете баланса
окислительного состояния базальтов углерод задавался в виде СО2,
прирост его содержания происходит в основном за счет метана. Это не вполне
соответствует данным по океанским гидротермам, где в растворенных газах СО2
преобладает над СН4 (см.табл.3.4,
3.7).
Интенсивные параметры системы и определяющие их
процессы.
Кислотно-щелочные условия (рН). Нисходящая ветвь
системы в целом характеризуется околонейтральными величинами рНТ,
находящимися в пределах 2 единиц от нейтрального для данной температуры
значения. Наблюдается вполне определенный тренд в сторону возрастания рН(Т)
с повышением П/В. Растворы, контактирующие с I минеральной ассоциацией, имеют
рНТ 4-5, тогда как для II ассоциации значения более высокие - от 5
до 7 (см.табл. 4.1). При переходе от одной ассоциации к другой наблюдается
скачок рН примерно на 1 единицу (см.табл.
4.1д).
В области I минеральной ассоциации рН раствора определяется осаждением
минералов Mg - талька и хлорита, и поэтому контролируется в основном составом
раствора - количеством в нем Mg.
При высоких
П/В кислотность раствора определяется реакциями II минеральной ассоциации
(эпидот + альбит + хлорит + актинолит) с Na и Ca, содержащимися в растворе.
Проведенные численный эксперимент по добавлению сильной кислоты (HСl) в реактор
на ступени 370oС (табл.4.2а)
показывает, что метасоматизированная порода является эффективным буфером рН.
При добавлении в систему 20 ммоль кислоты рН изменяется всего на 0,1 ед. (при
25o добавка такого количества кислоты к морской воде сдвинула бы рН с 8
примерно до 2 !). Одновременно в раствор выделяется большое количество Са, из
раствора связывается Na, в эпидоте повышается доля клиноцоизитового минала
(Эп60), и он частично растворяется, увеличивается количество железистого
хлорита и альбита (см.табл.4.2а). Эту
реакцию в упрощенном виде можно записать как
12Эп + 35H+
+ 6H2 + 9Na+  Кцо + 4Дф + 9Аб + 22Ca2+
+ 17Н2О(4.1) Кцо + 4Дф + 9Аб + 22Ca2+
+ 17Н2О(4.1)
Полученное
уравнение похоже на реакцию, выведенную в работе [Seyfried et al., 1988] по
результатам опытов в системе вода-базальт.
Для
сопоставления с наблюдательными данными по природным аналогам нам необходимо
перейти от величин рНТ к рН25 . Для этого был проведен
следующий численный эксперимент: растворы, полученные при расчете нисходящей
ветви, были пересчитаны на равновесное состояние при 25oС, при этом было
"запрещено" образование твердых фаз, кроме сульфидов и аморфного кремнезема, и
восстановление углекислоты до метана. Этот эксперимент приблизительно
соответствует закалке природных гидротермальных растворов при пробоотборе3.
Пересчитанные значения рН25 оказываются систематически ниже, чем рНТ,
причем величина сдвига растет с повышением температуры и понижением давления
гидротермального раствора, достигая 2-3 единиц рН. В результате значения рН25
для растворов, полученных при  П/В более 0,2 оказываются в интервале от
3,5 до 4,05 (см.табл.4.1), что хорошо соответствует наблюдаемым в природе
величинам (2,7-4,5 - см.табл.3.4). Самые низкие значения рН25 около
2 получены при пересчете растворов, равновесных в II ассоциацией при
температуре 425oС и давлении 400 бар, величины рНТ которых были
около 6. П/В более 0,2 оказываются в интервале от
3,5 до 4,05 (см.табл.4.1), что хорошо соответствует наблюдаемым в природе
величинам (2,7-4,5 - см.табл.3.4). Самые низкие значения рН25 около
2 получены при пересчете растворов, равновесных в II ассоциацией при
температуре 425oС и давлении 400 бар, величины рНТ которых были
около 6.
Смещение
величин рН при охлаждении связано, во-первых, с балансом гидролитических
реакций между компонентами раствора - гидроксокомплексами Al и Fe, с одной
стороны, и недиссоциированными формами кислот
 и H2S0- с другой, и,
во-вторых, с выпадением сульфидов, которое протекает с подкислением раствора
(этот эффект подробно описан в работе [Рафальский, 1993]): и H2S0- с другой, и,
во-вторых, с выпадением сульфидов, которое протекает с подкислением раствора
(этот эффект подробно описан в работе [Рафальский, 1993]):
 . .
Для области
низких П/В и высоких Т важную роль в сдвиге рН играет диссоциация частицы
 , концентрация которой может достигать при таких условиях n ммоль/кг. При высоких Т и П/В и низких Р отмеченные выше большие смещения рН связаны с диссоциацией
частицы HCl0. , концентрация которой может достигать при таких условиях n ммоль/кг. При высоких Т и П/В и низких Р отмеченные выше большие смещения рН связаны с диссоциацией
частицы HCl0.
Окислительно-восстановительные условия и
растворенный водород. Окислительно-восстановительные условия в нисходящей ветви определяются
соотношениями валентных форм железа, серы, углерода и водорода. Переменная
валентность в моделируемой мультисистеме возможна также для меди, но ее
содержания очень малы и не влияют на характер происходящих процессов.
В
метасоматитах, развивающихся по базальтам основной переменно-валентный элемент
- это железо. В пределах I ассоциации железо находится в форме гематита (FeIII)
и железо-магнезиального хлорита (FeII) (см.рис.4.1б, 4.2а). При переходе ко II ассоциации железо распределяется между
эпидотом (FeIII) и железистым хлоритом (FeII), а с
возрастанием П/В - также сульфидами и актинолитом. Отношение FeIII/ Fe
на всех ступенях модели выше, чем в исходном базальте (0,15) - это
свидетельствует о протекании реакции окисления железа окислителями,
содержащимися в исходной морской воде - О2, Fe
на всех ступенях модели выше, чем в исходном базальте (0,15) - это
свидетельствует о протекании реакции окисления железа окислителями,
содержащимися в исходной морской воде - О2,
 , а при высоких температурах - и с Н2О. Поскольку
запас О2 и , а при высоких температурах - и с Н2О. Поскольку
запас О2 и  в растворе ограничен,
образование эпидота приводит к постепенному накоплению в растворе водорода
(см.рис.4.1е), концентрация которого
достигает в некоторых вариантах расчета n в растворе ограничен,
образование эпидота приводит к постепенному накоплению в растворе водорода
(см.рис.4.1е), концентрация которого
достигает в некоторых вариантах расчета n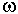 10-2 моль/кг. В
растворе накапливается также метан, однако поскольку углерода в системе
немного, метан оказывается третьим по значению восстановительным компонентом в
растворе (после H2S и H2). 10-2 моль/кг. В
растворе накапливается также метан, однако поскольку углерода в системе
немного, метан оказывается третьим по значению восстановительным компонентом в
растворе (после H2S и H2).
Для
интерпретации данных моделирования важно определить, какие факторы контролируют
окислительно-восстановительное состояние системы. Численный эксперимент по
добавлению восстановителя в систему (см.табл.4.2б) показал, то происходящие при этом изменения описывается
уравнением:
30Эп + 8Клх +
16Аб + 8 Ca2+ + 15H2  24Кцо + 5Дф + 10Акт80 + 16Na+.(4.2)
24Кцо + 5Дф + 10Акт80 + 16Na+.(4.2)
Как и в случае
воздействия кислоты (ур-ние 4.1), в этой реакции происходит восстановление Fe,
с переходом его из эпидота в железистый хлорит, но по воздействию на состав
раствора она имеет противоположную направленность - Са здесь не выделяется, а
связывается в обмен на выделение Na. Воздействие восстановителя практически не
оказывает влияния на рН системы (см.табл.4.2б).
Уравнение (4.2) включает растворенные Ca и Na, вследствие чего
окислительно-восстановительное состояние системы будет зависеть от их
соотношения:
 .(4.3) .(4.3)
Поэтому II
минеральная ассоциация не является окислительно-восстановительным буфером в
классическом понимании (типа NNO или QFM). Обменая реакция (4.2) только
накладывает связи, но не контролирует fH2. Емкость системы в отношении восстановителей оказалась
очень невелика - уже при добавлении 3 ммоль Н2 фазовая ассоциация
меняется, начинается восстановление  до метана, и с затем
прирост содержания Н2 в растворе ( до метана, и с затем
прирост содержания Н2 в растворе ( (Н2) в
таблице 4.2б) становится практически
равным введенному в систему количеству водорода (то есть буферность в отношении
восстановления отсутствует). (Н2) в
таблице 4.2б) становится практически
равным введенному в систему количеству водорода (то есть буферность в отношении
восстановления отсутствует).
В отношении
окислителя буферность системы существенно больше (см.табл.4.2в). Добавка к II минеральной ассоциации
кислорода сдвигает реакцию (4.2) влево, при этом раствор обогащается Ca2+
в обмен на Na+, а железо, содержащееся в породе, подвергается
окислению и переходит из хлорита и актинолита в эпидот. Однако эти изменения
заметно проявляются только при существенной добавке кислорода - более 30
ммоль/кг раствора (см.табл.4.2в). При
дальнейшем поступлении кислорода из системы исчезают сульфиды, появляются
ангидрит и растворенные сульфаты, гематит. Окисление системы сопровождается
понижением рН.
Контроль
окислительно-восстановительного состояния среды в области II ассоциации
создается балансом катионов, выделяющихся при необратимой реакции раствора со
базальтом. В показанном на рис.4.1 варианте для ступени с температурой 300oС и  П/В
= 0,169 этот баланс имеет вид (в молях вещества на 1 кг исходной породы): П/В
= 0,169 этот баланс имеет вид (в молях вещества на 1 кг исходной породы):
Базальт + 1,62
H2O + 0,123 Na+
 0,917 Аб + 0,198 Хл + 0,593 Эп + 0,428 Акт + 0,023
H4SiO4 + 0,917 Аб + 0,198 Хл + 0,593 Эп + 0,428 Акт + 0,023
H4SiO4 +
+ 0,038 K+
+ 0,042 Ca2+ + 0,0017 Fe2+ + 0,0016 OH- +
+ 0,015 H2
+ 0,018 CH4 + 0,0175 H2S(4.4)
При 370oС и  П/В
= 0,732 аналогичный баланс имеет вид: П/В
= 0,732 аналогичный баланс имеет вид:
Базальт + 1,58
H2O + 0,110 Na+ 
 0,903 Аб + 0,192 Хл + 0,582 Эп + 0,443 Акт + 0,0016
H4SiO4 + 0,903 Аб + 0,192 Хл + 0,582 Эп + 0,443 Акт + 0,0016
H4SiO4 +
+ 0,038 K+
+ 0,033 Ca2+ + 0,0051 Fe2+ + 0,00015 Zn2+ +
0,0055 OH- +
+0,035 H2
+ 0,0081 CH4 + 0,0183 H2S(4.5)
При повышении
П/В образующийся эпидот содержит большую долю клиноцоизитового минала, а хлорит
- дафнитового (в расчете это отражается в смене промежуточных фаз постоянного
состава Эп > Эп75 Эп75
 Эп60 и Клх Эп60 и Клх  Хл50
Хл50  Хл75 - рис.4.1б). За счет этого отношение FeIII/ Хл75 - рис.4.1б). За счет этого отношение FeIII/ Fe
вдоль линии тока постепенно понижается, стремясь к величине 0,30-0,32. Тем
самым устанавливается баланс между восстановительными "ресурсами" породы и
накоплением восстановленных продуктов в движущемся растворе. Fe
вдоль линии тока постепенно понижается, стремясь к величине 0,30-0,32. Тем
самым устанавливается баланс между восстановительными "ресурсами" породы и
накоплением восстановленных продуктов в движущемся растворе.
Микроэлементы - рудные металлы. Поведение рудных элементов
тесно связано со сменой метасоматических ассоциаций.
Медь в области существования I минеральной ассоциации
преимущественно выносится из породы за счет того, что халькопирит базальтов
окисляется и растворяется морской водой. В области существования II ассоциации
в равновесии с раствором устойчивы халькопирит, борнит (при высоких Т и малых П/В) и халькозин (вдоль
границы ассоциаций) (см.рис.4.2а).
Из-за высоких содержаний Н2S равновесная растворимость меди в зоне
II ассоциации резко снижается, и она перестает быть миграционно способной.
Окислительно-восстановительный барьер на границе I и II ассоциаций разделяет
участки нисходящей ветви с высокой и низкой подвижностью меди (см.рис.4.1г), и следовательно, оказывается по
отношению к этому элементу барьером осаждения. Для меди главная форма миграции
во всем диапазоне условий -  (см.рис.4.4в). (см.рис.4.4в).
Поведение цинка в модели более просто - он
выносится из области I ассоциации и малоподвижен в области II ассоциации, где
из-за высоких содержаний Н2S осаждается в виде сфалерита (см.рис.4.2а). Нужно отметить, что граница
появления сфалерита на рис.4.2а не
точно совпадает со сменой ассоциаций - при высоких Т она смещена в сторону больших П/В. Равновесная со сфалеритом
концентрация Zn зависит от температуры - вследствие усиления
комплексообразования она постепенно возрастает с ростом Т, достигая при 400oС n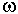 10-4 моль/кг
(см.рис.4.1г). 10-4 моль/кг
(см.рис.4.1г).
Эти же
тенденции проявлены и для поведения свинца.
Также, как Zn и Cu, он хорошо мигрирует в области устойчивости I ассоциации и
малоподвижен при высоких П/В в присутствии Н2S. Граница
существования галенита сдвинута к большим П/В, как и у сфалерита, и в пределах
области II ассоциации у Zn и Pb сохраняются возможности для переноса. Главные
формы переноса Zn при низких температурах - ZnCl+ и
 , и при высоких - , и при высоких -
 , а для свинца, соответственно - , а для свинца, соответственно -
 и и  (см.рис.4.4г,д). (см.рис.4.4г,д).
Сравнение
поведения Cu, Zn и Pb в нисходящей ветви модели представляет существенный
интерес. Почти во всей области устойчивости I ассоциации они полностью
выносятся из породы, и поэтому отношение их содержаний в растворе соответствует
отношению содержаний в исходных базальтах (Zn = Cu > Pb). Это
соотношение сохраняется постоянным при увеличении концентраций элементов в
растворе, связанном с ростом П/В при повышении температуры. В области II
ассоциации, после достижения насыщения по соответствующему сульфиду,
концентрации элементов резко понижаются. Этот перелом происходит в
последовательности: Cu Zn, Pb, и в высокотемпературной части системы
модель "первой волны" (см.рис.4.1г)
дает в растворе Zn > Cu = Pb. Таким образом, согласно модели растворы на начальном этапе жизни
высокотемпературных гидротермальных систем имеют существенное обогащение цинком
по отношению к меди и свинцу. Zn, Pb, и в высокотемпературной части системы
модель "первой волны" (см.рис.4.1г)
дает в растворе Zn > Cu = Pb. Таким образом, согласно модели растворы на начальном этапе жизни
высокотемпературных гидротермальных систем имеют существенное обогащение цинком
по отношению к меди и свинцу.
Из данных
расчетов следует, что относительная подвижность (то есть доля растворенного
металла от общего содержания его на ступенях реактора) этих элементов убывает в
ряду Pb(23o/o) > Zn(12o/o) > Cu(0,9o/o)4. Этот ряд не совсем совпадает
с растворимостью их сульфидов, которая в условиях, заданных для модели
соотносится как Zn > Cu = Pb (см.рис.4.1г).
На относительной подвижности сказывается то, что содержание Pb в исходной
породе на 2 порядка меньше, чем Zn и Cu. Поэтому даже при сравнительно низкой
растворимости Pb может быть полностью мобилизован раствором из породы, тогда
как более растворимый Zn частично сохраняется в метасоматитах в виде сфалерита.
|

