Правила смещения
кислотно-основных равновесий, геохимическое
разделение элементов и запрещенные минералы
(разрешенные и запрещенные сочетания элементов)
В конечном счете разделение элементов
на отдельные геохимические
группы определяется направлением обменных
равновесий типа
AX + BY => AY + BX
(1)
С термодинамической точки зрения вопрос
решается просто: если тепловой эффект
такой реакции достаточно большой по величине и
имеет отрицательный знак (dH(1) < 0, реакция (1) экзотермическая), то по принципу
Бертло она смещена вправо, в сторону
образования соединений AY и BX.
Если все кристаллы, участвующие в
реакции (1), чисто ионные, то по приближенному уравнению A.Ф. Капустинского энергия решетки любого из
четырех участвующих в реакции кристаллов может
быть представлена в виде
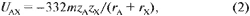
где m - число атомов в молекуле AX (в данном
случае m = 2), zA и zX - валентности
(заряды ионов z +, z-), rA и rX -
радиусы катиона A и аниона B. Здесь и далее
энергетические величины выражены в ккал/моль и
относятся либо к молю вещества, задаваемого
формульной единицей, либо к соответствующему
количеству веществ, участвующих в химической
реакции. Аналогичные формулы для энергии решетки
могут быть записаны для остальных трех
кристаллов. Затем нетрудно отыскать величину dH(1):
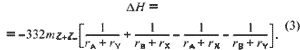
В данном случае для выполнения неравенства dH(1) <
0 необходимо, чтобы в стабильной паре кристаллов
(AY и BX) один из них, например AY, был сочетанием
наименьших по размеру катиона и аниона (например,
rA < rB и rY < rX ), а второй -
сочетанием наиболее крупных по размеру катиона и
аниона (BX). Именно это обеспечивает
энергетический выигрыш, например, в реакции
LiCl + NaF = > LiF + NaCl,
которая сопровождается заметным экзотермическим
тепловым эффектом (dH = -11 ккал/моль),
стабильно образуются кристаллы из самых мелких
(Li+, r = 0,70 A, F- , r = 1,33 A) и самых
крупных (Na+ , r = 1,00 A, Cl - , r = 1,81 A)
ионов. И действительно, в природе обычен галит NaCl, а виллиомит NaF
очень редок.
Подобным же образом решаются и другие
варианты этой задачи, если по-прежнему
использовать приближение (2). Так, если в реакции
участвуют ионы с разными зарядами, то в
стабильной паре кристаллов оказывается
соединение катиона и аниона с более высокими
зарядами, например:
Na2SO4 + MgCl2 =>
2NaCl + MgSO4; dH = -18 ккал.
Здесь ведущим оказывается процесс
образования кристалла MgSO4 , в котором
сочетаются двухвалентные катион и анион.
Однако при переходе к более широкому
кругу веществ обнаружились серьезные
расхождения предсказаний ионной
теории с наблюдениями и экспериментом. Вот
лишь один из примеров:
ZnF2 + CaS => ZnS + CaF2;
dH = -46 ккал.
В этой обменной реакции, согласно ионным
правилам, должно быть стабильным сочетание более
мелкого катиона Zn2+ с более мелким анионом F-
. Но опыт показывает (и это подтверждается очень
большим экзотермическим тепловым эффектом
реакции), что имеется практически полное
смещение равновесия в другую сторону, в сторону
образования сфалерита ZnS и флюорита
CaF2 . И если эти минералы хорошо известны и
широко встречаются, то ZnF2 отсутствует в
природе совсем, а ольдгамит CaS
найден только в метеоритах.
Из анализа подобных исключений следует,
что в стабильной паре соединений оказывается
наиболее ковалентное (ZnS, разность
электроотрицательностей dx = 0,9) и наиболее ионное
(CaF2, разность электроотрицательностей dx =
3,0) сочетания элементов, которые являются также
сочетаниями слабой льюисовской
(или обобщенной) кислоты (S) и слабого основания
(Zn), а также сильной кислоты
(F) и сильного основания (Ca). Эта формулировка
полностью соответствует старому правилу
химиков: сильная кислота предпочитает
взаимодействовать с сильным основанием, а слабая
кислота - со слабым основанием.
Принципиальное значение имеет решение
вопроса о сродстве элементов к
кислороду и сере, поставленного еще на заре геохимии и кристаллохимии В.М. Гольдшмидтом (который был одним из
создателей этих наук), ибо ответ на него явился бы
объяснением геохимического разделения
элементов на такие большие группы, как литофилы и халькофилы.
Уже давно было отмечено, что литофилы, то есть
элементы, склонные давать кислородные
соединения, образуют в них существенно ионные связи, а халькофилы
(элементы, склонные к устойчивым соединениям с
серой и ее аналогами) образуют с ними существенно
ковалентные
соединения. Однако само по себе это правильное
замечание еще не объясняет сущности сродства.
Выявить его можно лишь теоретически анализируя
причины смещения равновесия в обменных реакциях
типа
SiS2 + MoO2 =>
SiO2 + MoS2; dH = -101 ккал,
Кварц
молибденит
CaS + PbCO3
=> PbS + CaCO3
; dH = -32 ккал.
Ольдгамит Церуссит Галенит
Кальцит
В устойчивых парах здесь оказываются минералы
весьма распространенных ассоциаций (кварц
и молибденит, галенит и кальцит), тогда как противоположные им
пары либо не встречаются в природе совсем (SiS2
и MoO2 ), либо никогда не встречаются вместе (ольдгамит - минерал некоторых метеоритов, церуссит -
минерал гидротермальных жил), ибо их
реакция между собой привела бы к появлению более
устойчивой пары.
Простой анализ этих равновесий
возможен, если прибегнуть к постулату Л. Полинга,
согласно которому энергия связи соединения
может быть подсчитана по уравнению
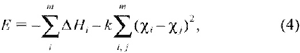
где dH i - энтальпия образования
i-атома из соответствующего простого вещества в
стандартном (Т = 298 К, Р = 1 атм) состоянии, m - число
атомов в формуле соединения, хi , хj - электроотрицательности
связанных между собой атомов, k - некоторая
положительная константа.
Тогда уравнение для теплоты реакции (1) будет
следующим:
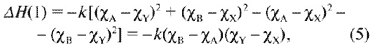
так как все тепловые эффекты
образования атомов из простых веществ взаимно
сократятся.
Отрицательное значение правая сторона
уравнения (5) принимает тогда, когда в стабильной
паре соединений оказывается сочетание более
электроположительного катиона A (хA < хB)
и более электроотрицательного аниона Y (хY
> хX), а следовательно, и более
электроотрицательного катиона В и менее
электроотрицательного аниона Х. Это означает,
что устойчивым является действительно сочетание
наиболее ионного AY и
наиболее ковалентного
BX из четырех возможных соединений.
Особенно большой выигрыш энергии в
таких обменных реакциях обеспечивается в том
случае, когда правило максимальной полярности
связи действует одновременно с правилом
сочетания меньшего по размеру катиона и меньшего
по размеру аниона (как при образовании кварца
SiO2 и молибденита MoS2 в
одном из приведенных выше примеров).
Именно такого рода равновесия и
приводят к резкому разделению элементов по
признаку их сродства к кислороду и сере - на
литофилы и халь-
кофилы соответственно. Появление стабильных
сочетаний внутри отдельных классов минералов (силикатов, сульфидов)
строго подчиняется тем же правилам
смещения обменных равновесий. Таким путем
удалось объяснить, например, постоянную связь золота с теллуром, а меди с серой. Стало
понятным характерное сочетание небольших и
высоко заряженных катионов (Mg2+ , Fe2+ , Al3+
, Si4+ ) c ортосиликатным
анионом [SiO4]4- в островных
структурах (оливин, гранат,
кианит), а более крупных и с низкими
зарядами (Na+ , K+ , Ca2+ ) - c большими
по размеру алюмосиликатными анионами типа [AlSi3O8]
- в каркасных структурах (полевые
шпаты, фельдшпатоиды).
Итак, именно смещение
обменных равновесий, подчиняющееся
кристаллохимическим и термодинамическим
законам, является основным способом
естественного отбора среди минеральных видов и
способствует широкому распространению одних из
них за счет полного отсутствия других.
Следующая страница| Назад
|

