Моделирование фазовых равновесий при кристаллизации базальтовых магм
Назад | Оглавление|
Далее
Используя базу данных ИНФОРЭКС-4.0,
мы провели поиск экспериментов по
плавлению образцов земных изверженных
пород и синтетических базальтовых смесей,
где в качестве продуктов закалки
присутствует обогащенная железом и титаном
шпинель. Задача ставилась
следующим образом: из числа экспериментов,
проведенных при атмосферном давлении в
отсутствии летучих компонентов, найти
опыты, где имеются данные по составам
расплавов, равновесных с титаномагнетитом
19
.В результате этого поиска было найдено 213
экспериментов из 22 работ, причем примерно
половина из них относится к опытам с
образцами щелочных базальтов и нефелинитов.
Для последующего анализа из этой выборки мы
выбрали только опыты в системах низкой и
умеренной щелочности, введя дополнительные
ограничения на составы закалочных
стекол (Na2O+K2O < 7 мас.%) и
продолжительность плавок (не менее 48 часов).
В базе данных ИНФОРЭКС было
найдено 99 экспериментов, отвечающих этим
критериям и представляющих 13 независимых
исследований.
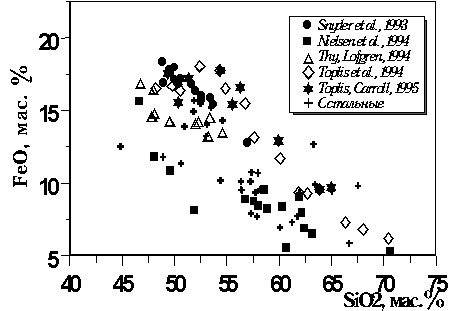
Большинство этих экспериментов
характеризуют системы ферро-базальтового и
ферроандезит-базальтового состава (10-18 мас.%
FeO, Рис.
4.7), при вариациях
содержания TiO2 в
остаточных расплавах от
1 до 5 мас.%. Диапазон
температур кристаллизации титаномагнетита
составляет 1040-1160оС (Рис.
4.8).
 |
|
Рис. 4.7. Характеристики
состава базовой выборки
экспериментальных стекол, отвечающих
равновесию магнетит-расплав
|
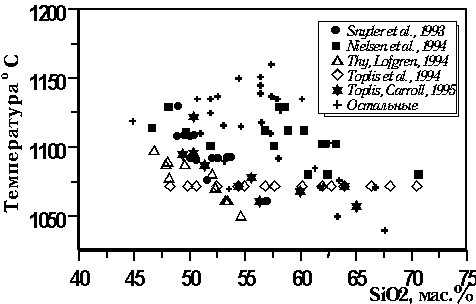 |
| Рис. 4.8. Зависимость
температуры ликвидуса от состава для
базовой выборки экспериментальных
стекол, отвечающих равновесию магнетит-расплав |
Все опыты проведены методом
"платиновой петли" в условиях
контролируемой фугитивности
кислорода, которая менялась
в диапазоне 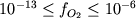 бар: это
отвечает интервалу буферных равновесий IW
- NNO+2 (Рис.
4.9). Полученные в результате этих
экспериментов фазовые ассоциации включают
обычно 4-5 минералов + закалочное стекло,
причем за исключением нескольких случаев, 4-й
или 5-й кристаллизующейся фазой является
именно Mt. Плагиоклаз присутствует на
ликвидусе всех 99 составов; фемические фазы
представлены Ol, Aug, Pig и Opx в различных
сочетаниях. В 49 опытах установлено
присутствие ильменита: появление этой фазы
отмечается для экспериментов в
восстановительных условиях log fO2 <
-10. бар: это
отвечает интервалу буферных равновесий IW
- NNO+2 (Рис.
4.9). Полученные в результате этих
экспериментов фазовые ассоциации включают
обычно 4-5 минералов + закалочное стекло,
причем за исключением нескольких случаев, 4-й
или 5-й кристаллизующейся фазой является
именно Mt. Плагиоклаз присутствует на
ликвидусе всех 99 составов; фемические фазы
представлены Ol, Aug, Pig и Opx в различных
сочетаниях. В 49 опытах установлено
присутствие ильменита: появление этой фазы
отмечается для экспериментов в
восстановительных условиях log fO2 <
-10.
 |
| Риc.
4.9.
Зависимость
летучести кислорода от температуры для
базовой выборки экспериментальных
стекол, отвечающих равновесию магнетит-расплав |
Обзор специальных
исследований стабильности магнетита
Наиболее представительные
исследования включают 5 работ (Snyder
et al.,
1993; Nielsen et al., 1994; Thy, Lofgren, 1994; Toplis et al.,
1994b; Toplis, Carroll, 1995), на результатах
которых имеет смысл остановиться подробнее.
(1) Snyder
et al. (1993).
В этой работе приведены результаты 53 опытов
на образцах ферробазальтов, которые по
составу рассматриваются в качестве
аналогов продуктов фракционирования
исходных магм для одного из расслоенных
комплексов Лабрадора и Скергаардского
интрузива (Табл.
4.1). За исключением 3-х случаев, эти опыты
проведены в диапазоне температур 1060-1190оС
и значений 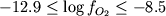 . Для 18 экспериментов
среди закалочных продуктов установлен магнетит;
в 15 случаях определены составы
сосуществующих закалочных стекол (см.
залитые кружки на Рис.
4.7-4.9).
Важно отметить, что все магнетитсодержащие
ассоциации (Ol+Pl+Mt Px
Ilm) получены в экспериментах
продолжительностью t > 100
часов, что позволяет предполагать близкие к
равновесным условия. Полученные данные
показывают, что температуры кристаллизации
титаномагнетита не превышают 1130оС и
при летучести fO2 близкой буферу
QFM сильно зависят от окислительно-восстановительных
условий (на Рис.
4.9 эта область расположена посередине
между линиями WM и NNO). Выделение Mt
приводит к резкому обеднению расплавов FeO и
обогащению SiO2 (Рис.
4.7). . Для 18 экспериментов
среди закалочных продуктов установлен магнетит;
в 15 случаях определены составы
сосуществующих закалочных стекол (см.
залитые кружки на Рис.
4.7-4.9).
Важно отметить, что все магнетитсодержащие
ассоциации (Ol+Pl+Mt Px
Ilm) получены в экспериментах
продолжительностью t > 100
часов, что позволяет предполагать близкие к
равновесным условия. Полученные данные
показывают, что температуры кристаллизации
титаномагнетита не превышают 1130оС и
при летучести fO2 близкой буферу
QFM сильно зависят от окислительно-восстановительных
условий (на Рис.
4.9 эта область расположена посередине
между линиями WM и NNO). Выделение Mt
приводит к резкому обеднению расплавов FeO и
обогащению SiO2 (Рис.
4.7).
Таблица 4.1. Составы
исходных образцов, использованных при
экспериментальных исследованиях
равновесия магнетит-расплав
| Ссылка |
Snyder
et al., 199
|
Nielsen
et al., 1994
|
Thy,
Logfren, 1994
|
Toplis
et al., 1994-95
|
|
Обр.
|
4-3
|
4-83C
|
SK
|
T85-77
|
121492
|
V-31
|
9005
|
7159V
|
8754
|
SAX2
|
SC4
|
SC1
|
SC4a
|
|
SiO2
|
48.63
|
47.07
|
50.28
|
45.87
|
50.64
|
63.83
|
48.31
|
48.37
|
47.50
|
46.18
|
50.47
|
48.75
|
49.45
|
|
TiO2
|
2.33
|
3.90
|
2.56
|
4.14
|
2.96
|
0.74
|
4.52
|
4.01
|
4.08
|
3.80
|
4.38
|
2.90
|
4.37
|
|
Al2O3
|
14.57
|
13.65
|
13.69
|
15.16
|
15.05
|
15.09
|
13.11
|
13.80
|
12.59
|
15.23
|
11.73
|
14.89
|
11.68
|
|
FeO*
|
14.71
|
17.65
|
13.28
|
12.54
|
14.23
|
8.31
|
14.90
|
14.26
|
15.22
|
13.59
|
14.89
|
13.09
|
16.45
|
|
MnO
|
0.21
|
0.22
|
0.26
|
0.18
|
0.23
|
0.20
|
0.21
|
0.19
|
0.23
|
0.23
|
-
|
-
|
-
|
|
MgO
|
6.29
|
4.75
|
6.58
|
5.16
|
4.57
|
0.36
|
4.82
|
3.31
|
5.17
|
5.47
|
4.89
|
6.49
|
4.67
|
|
CaO
|
9.27
|
7.72
|
10.22
|
11.04
|
8.46
|
4.27
|
9.41
|
9.04
|
10.93
|
10.43
|
10.20
|
10.89
|
9.85
|
|
Na2O
|
3.05
|
3.63
|
2.62
|
3.53
|
2.39
|
4.13
|
3.21
|
4.87
|
3.25
|
3.29
|
2.96
|
2.70
|
3.05
|
|
K2O
|
0.72
|
1.05
|
0.51
|
1.87
|
0.95
|
2.87
|
0.89
|
1.28
|
0.65
|
1.06
|
0.49
|
0.30
|
0.50
|
|
P2O5
|
0.23
|
0.36
|
0.00
|
0.50
|
0.52
|
0.19
|
0.60
|
0.88
|
0.38
|
0.72
|
-
|
-
|
-
|
Примечание.
Составы образцов пересчитаны
на безводную основу; все железо в виде FeO
(2) Nielsen
et al. (1994) привели данные 16
экспериментов на 7 образцах базальтов и
андезитов (составы некоторых из них
представлены в Табл. 4.1). Эти опыты
направлены на изучение стабильности
магнетита в условиях несколько выше и ниже
буфера NNO; таким образом, Mt
присутствует на ликвидусе всех 16 составов.
Эксперименты проводились при температурах
1080-1129оС в диапазоне фугитивностей
кислорода 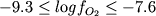 ; длительность опытов составляла не
менее 72 часов. Данные Рис. 4.7-4.9 (см. залитые
квадраты) подтверждают зависимость
температуры кристаллизации Mt от
летучести кислорода, при этом обеднение
расплавов FeO и обогащение SiO2 отмечается
как для базальтовых, так и для андезитовых
составов. ; длительность опытов составляла не
менее 72 часов. Данные Рис. 4.7-4.9 (см. залитые
квадраты) подтверждают зависимость
температуры кристаллизации Mt от
летучести кислорода, при этом обеднение
расплавов FeO и обогащение SiO2 отмечается
как для базальтовых, так и для андезитовых
составов.
(3) Thy
and Lofgren (1994) исследовали влияние
состава расплава на температуры
кристаллизации магнетита вдоль буфера QFM
(треугольники на Рис.
4.9). В качестве исходных составов в этих
опытах использовались 4 образца умеренно
щелочных ферробазальтов, содержащих 13.5-15.2
мас.% FeO и 3.9-6.1 мас.% Na2O+K2O (Табл.
4.1). Для 15 из 46 проведенных опытов в
конечных продуктах было установлено
наличие магнетита (  часов). Температуры кристаллизации Mt в
этих экспериментах варьируют от 1051оС
до 1098оС, при этом тренды обеднения
расплавов FeO и обогащения SiO2 проявлены
весьма отчетливо (Рис.
4.7). Важный вывод этой работы состоит в том,
что независимо от исходного состава,
начальные температуры появления Mt в
кристаллизационной последовательности
составляют 1105 5оС.
часов). Температуры кристаллизации Mt в
этих экспериментах варьируют от 1051оС
до 1098оС, при этом тренды обеднения
расплавов FeO и обогащения SiO2 проявлены
весьма отчетливо (Рис.
4.7). Важный вывод этой работы состоит в том,
что независимо от исходного состава,
начальные температуры появления Mt в
кристаллизационной последовательности
составляют 1105 5оС.
(4) Toplis
et al. (1994b) представили результаты 34
изотермических опытов при T=1072oC с
образцом синтетического ферробазальта,
дозированным различными количествами P2O5
(Табл.4.1,
11-я колонка). Хотя эта работа акцентирована
на изучение влияния фосфора на фазовые
равновесия силикатных фаз, она включает
данные 15 экспериментов, где ликвидусной
фазой является Mt (незалитые ромбики на Рис.
4.7-4.9).
Продолжительность экспериментов
составляла не менее 149 часов, а спектр
составов закалочных стекол охватывает
диапазон от ферробазальтов до дацитов. По
результатам этих опытов магнетит
кристаллизуется в интервале буферных
равновесий примерно от QFM-0.7 до QFM+1.9.
(5) Toplis
and Carroll (1995)
дополнили результаты предыдущего
исследования 10 новыми экспериментами в
области равновесия Mt-расплав.
Эксперименты проводились с образцами трех
синтетических ферробазальтов (Табл.4.1,
колонки 11-13) при температурах 1057-1122оС
в диапазоне -11.2 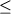 logfO2 logfO2 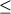 -8.1. Длительность
опытов составляла более 115 часов: на Рис.
4.7-4.9
эти данные обозначены шестиконечными
звездочками. Как и для рассмотренных выше
экспериментов, составы закалочных стекол
указывают на закономерное понижение
содержания FeO от "базальтов" к "дацитам",
при этом в области андезит-дацитовых
составов температуры кристаллизации Mt
варьируют около 1070оС. Работа (Toplis,
Carroll,
1995) представляет по-видимому наиболее
полный анализ проблемы фазовых соотношений
и расплавно-минеральных равновесий при
кристаллизации толеитовых магм с участием
магнетита и ильменита. -8.1. Длительность
опытов составляла более 115 часов: на Рис.
4.7-4.9
эти данные обозначены шестиконечными
звездочками. Как и для рассмотренных выше
экспериментов, составы закалочных стекол
указывают на закономерное понижение
содержания FeO от "базальтов" к "дацитам",
при этом в области андезит-дацитовых
составов температуры кристаллизации Mt
варьируют около 1070оС. Работа (Toplis,
Carroll,
1995) представляет по-видимому наиболее
полный анализ проблемы фазовых соотношений
и расплавно-минеральных равновесий при
кристаллизации толеитовых магм с участием
магнетита и ильменита.
Отметим три важных результата
этого анализа. Во-первых, по данным расчетов
с использованием составов и пропорций
экспериментальных продуктов установлено,
что доля титаномагнетита в ассоциациях,
кристаллизующихся в открытых по кислороду
условиях, может достигать 15-22 мас.% -
очевидно, это главный фактор, определяющий
обогащение остаточных расплавов SiO2
при выделении Mt-содержащих
парагенезисов. Во-вторых, в интервале
буферных равновесий от QFM-2 до QFM+1 наклон
ликвидусной температуры Mt в
зависимости от fO2 составляет
примерно 30оС/lоgfO2.
И в-третьих, для насыщенных магнетитом
расплавов установлено, что существует
отрицательная корреляция между обратной
температурой и содержанием в жидкости Fe2O3:
это означает, что высоким температурам
кристаллизации магнетита отвечает
повышенная окисленность железа в расплавах.
Последовательного анализа зависимости
температуры насыщения Mt от состава
расплава и редокс условий Топлис и Кэрролл
не представили.
Проблема расчета Fe3+/Fe2+
в расплавах
Логичный способ построения
модели для предсказания стабильности
магнетита в силикатных расплавах
заключается в оценке отношения Fe3+/Fe2+
в жидкости, расчете констант равновесия
реакций кристаллизации, калибровке
соответствующих температурно-композиционных
зависимостей и разработке на этой основе
ЭВМ-программы, описывающей поведение твердых
растворов магнетита (Nielsen,
Dungan,
1983; Ghiorso, 1985; Арискин
и др.,
1987). Несмотря на то, что эти программы
доказали свою применимость при
интерпретации трендов фракционирования
ферробазальтовых магм (см. выше), их
внедрение в практику петрологических
исследований вызвало определенные
нарекания. В Главе 2 мы
уже отмечали, что программа КОМАГМАТ-3.0 (Ariskin
et al.,
1993) на 20-40оС завышала модельные
температуры кристаллизации Mt при
летучести кислорода выше QFM,
что приводило к занижению оценок fO2
по петрохимическим трендам или неудобствам,
связанным с необходимостью периодических
температурных коррекций. Не менее
неприятная ситуация выявилась при
тестировании последней версии программы MELTS
(Ghiorso,
Sack,
1995): расчеты в условиях переменного
режима fO2 указывали на понижение
модельной температуры Mt при увеличении
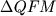 и повышении окисленности расплава (Toplis,
Carroll,
1996). и повышении окисленности расплава (Toplis,
Carroll,
1996).
По нашему
мнению, главная причина этих расхождений
кроется в проблемах оценки и использования
валового отношения Fe3+/Fe2+ в
силикатной жидкости для
низкотемпературных Mt-содержащих
парагенезисов. Эти проблемы включают три
момента:
(1) Данные анализа
экспериментальной информации по редокс-равновесиям,
имеющейся в базе данных ИНФОРЭКС
(всего 372 опыта), показывают, что при
калибровке уравнений зависимости Fe3+/Fe2+
в расплаве от состава и температуры около 40%
данных представляли сильно окисленные
жидкости при fO2 > 10-3 бар,
тогда как только 6 экспериментальных стекол
были получены при fO2 < 10-9
бар (Fudali,
1965; Shibata, 1967; Sack et al., 1980; Thornber et al.,
1980; Kilinc et al., 1983; Kress, Carmichael, 1988, 1991 - см.
раздел 2.3).
Таким образом, значительная часть исходных
данных относится к условиям fO2,
далеко выходящим за диапазон, характерный
для кристаллизации толеитовых
магм (Carmichael,
Ghiorso .,
1986, 1990), и слабо перекрывается с пределами
стабильности магнетита, установленной по
данным специальных исследований - Рис.
4.9. С этим связана дополнительная
проблема: сравнение точности уравнений для
расчета окисленности железа в
магматических расплавах показывает, что
для условий logfO2 < -10
относительная погрешность оценок Fe3+/Fe2+
может достигать 50% при абсолютной точности
0.03 (Николаев
и др.,
1996).
(2) Кинетические эксперименты,
проведенные при 1200oC и fO2 = 10-8
бар, показывают, что для уравновешивания
отношения Fe3+/Fe2+ в расплаве с
газовой фазой требуется от 5 до 24 часов (Fudali,
1965; Thornber et al., 1980). При fO2 = 10-6
бар продолжительность опытов должна быть
увеличена до 48 часов (Fudali,
1965). Если сравнить соотношения между
длительность-температура для опытов по
изучению редокс-равновесий (n=289) и
стабильности магнетита (n=99), то можно
заметить, что в первом случае
использовались единичные плавки > 48 часов,
причем ни один из составов, включающих
экспериментально определенные значения Fe3+/Fe2+,
не попадает в диапазон температур,
характерный для кристаллизации магнетита -
1040-1160oC (Рис.
4.8 и 4.10).
Эта проблема становится еще более острой,
если учесть, что экспериментальное
насыщение расплавов магнетитом происходит
не только при низкой температуре, но и в
условиях высокой закристаллизованности
систем (не менее 20-40%), что требует
дополнительного увеличения выдержек для
достижения равновесия.
|

|
| Рис. 4.10. Соотношения
между температурой и длительностью
опытов при исследованиях равновесий
Fe3+/Fe2+ в
жидкости (n=289)и Mt - расплав (n =99) |
(3) Данные мессбауэровской
спектроскопии силикатных стекол
показывают, что при Fe3+/ 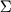 Fe<0.5 окисленное железо (ионы Fe3+)
присутствуют в двух разновидностях,
включающих тетраэдрическую
и октаэдрическую координацию (Mysen
et al.,
1985). Это означает, что любые попытки
рассчитать активность магнетита или Fe2O3
в расплаве на основании валовых отношений Fe3+/Fe2+,
будут ошибочны без учета разделения ионов Fe3+
по позициям. Fe<0.5 окисленное железо (ионы Fe3+)
присутствуют в двух разновидностях,
включающих тетраэдрическую
и октаэдрическую координацию (Mysen
et al.,
1985). Это означает, что любые попытки
рассчитать активность магнетита или Fe2O3
в расплаве на основании валовых отношений Fe3+/Fe2+,
будут ошибочны без учета разделения ионов Fe3+
по позициям.
Приходится признать, что
имеющаяся в настоящее время информация по
составу и структурному состоянию
силикатной жидкости недостаточна для
построения адекватной термодинамической
модели равновесия Mt-расплав, даже при
условии наличия корректной модели
активности компонентов магнетитового
твердого раствора (Sack,
Ghiorso,
1991; Ghiorso, Sack, 1995). Это приводит к
необходимости использовать эмпирические
подходы к описанию равновесий с участием
Fe-Ti оксидов.
На первом этапе мы поставили
задачу построения эмпирического уравнения
для расчета температур кристаллизации (ликвидусной
поверхности) Ti-Mt в максимально широком
диапазоне составов расплавов и летучести
кислорода (Арискин,
1998). Описанная выше
экспериментальная выборка из 99 составов
стекол, закаленных при заданных значениях T
и fO2, представляет для этого хорошую
эмпирическую основу. Обработка
экспериментальных данных проводилась по
линейной модели
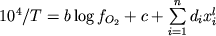 ,
(4.1) ,
(4.1)
где T - температура (K), 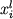 - мольные доли компонентов расплава; b, c
и di - регрессионные коэффициенты. При
проведении этих вычислений мы умышленно
исключили из рассмотрения Fe2O3 как
независимого компонента, оперируя только
валовыми концентрациями FeOобщ. Это
сделано с целью минимизировать погрешности
оценок отношения FeO/Fe2O3 в
расплавах (см. выше). Другая причина
связана с тем, что уравнения, предложенные
для расчета FeO/Fe2O3 не учитывают
влияния фосфора, которое по последним
данным может быть весьма существенным (Toplis
et al., 1994ab). Важное отличие этой
калибровки состоит также в том, что мы
исследовали возможность изменения
параметра b при летучести кислорода в
зависимости от состава жидкой фазы.
- мольные доли компонентов расплава; b, c
и di - регрессионные коэффициенты. При
проведении этих вычислений мы умышленно
исключили из рассмотрения Fe2O3 как
независимого компонента, оперируя только
валовыми концентрациями FeOобщ. Это
сделано с целью минимизировать погрешности
оценок отношения FeO/Fe2O3 в
расплавах (см. выше). Другая причина
связана с тем, что уравнения, предложенные
для расчета FeO/Fe2O3 не учитывают
влияния фосфора, которое по последним
данным может быть весьма существенным (Toplis
et al., 1994ab). Важное отличие этой
калибровки состоит также в том, что мы
исследовали возможность изменения
параметра b при летучести кислорода в
зависимости от состава жидкой фазы.
В общей сложности
проанализировано более 30 вариантов
линейной модели (4.1), где варьировались
набор и количество компонентов расплава.
Критерием поиска оптимального уравнения
являлась точность решения обратной задачи,
т.е. статистическая оценка степени
отклонения расчетных температур от
экспериментальных при заданном составе
расплава и летучести кислорода. В
результате было установлено, что наиболее
сильное влияние на устойчивость магнетита
оказывают 4 компонента расплава - SiO2,
TiO2, FeOобщ и P2O5, а
наилучшей точности решения обратной задачи
(порядка 10оС) удается достичь при
использовании уравнения вида:
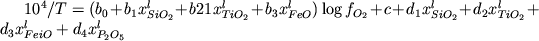 ,
(4.2) ,
(4.2)
Таблица 4.2.
Регрессионные коэффициенты к уравнению
ликвидуса магнетита (4.2)
| Параметр |
коэфф. |
1 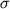 - откл - откл |
| b0 |
-0.6232
|
0.0205
|
| b1 |
0.6826
|
0.0359
|
| b2 |
4.0438
|
0.9327
|
| b3 |
0.8251
|
0.2567
|
| c |
0.0159
|
0.0686
|
| d1 |
8.3626
|
0.2804
|
| d2 |
35.9674
|
8.0819
|
| d3 |
10.7347
|
2.1842
|
| d4 |
12.4418
|
2.3521
|
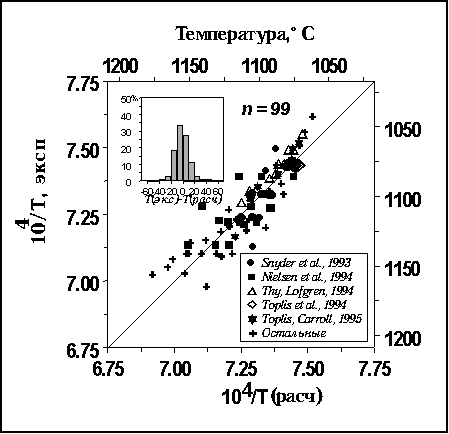
Как видно из этого рисунка, в
нескольких случаях эти отклонения
достигают 40-50оС, но в целом около 90%
данных попадают в интервал
15оС; среднее отклонение 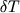 по абсолютной величине составляет 9.3оС. по абсолютной величине составляет 9.3оС.
|
|
|
Рис. 4.11.
Экспериментальные
и расчетные значения обратной
температуры для базовой выборки стекол,
отвечающих равновесию магнетит-расплав
Гистограмма дана для
отклонений
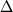 T=Tэксп-Tрасч
T=Tэксп-Tрасч
|
Заслуживает внимания, что в
случае данных работ (Snyder et al., 1993; Nielsen et
al., 1994; Thy, Lofgren, 1994; Toplis et al., 1994b; Toplis,
Carroll, 1995) эти отклонения не выходят за
пределы 30оС, а для 25 наиболее
продолжительных экспериментов (Toplis et al.,
1994b; Toplis, Carroll, 1995) среднее значение
 T=3.6оС. Высокая степень
воспроизведения представительной выборки
экспериментальных данных позволяет
предполагать, что найденная форма
эмпирической зависимости (4.2) является
отражением реальных редокс- и структурно-химических
равновесий в жидкой фазе, протекающих с
участием ионов Fe3+ и Fe2+ и
определяющих условия стабильности на
ликвидусе титаномагнетита.
T=3.6оС. Высокая степень
воспроизведения представительной выборки
экспериментальных данных позволяет
предполагать, что найденная форма
эмпирической зависимости (4.2) является
отражением реальных редокс- и структурно-химических
равновесий в жидкой фазе, протекающих с
участием ионов Fe3+ и Fe2+ и
определяющих условия стабильности на
ликвидусе титаномагнетита.
Влияние каждого выбранного
компонента можно конкретизировать при
помощи регрессионных коэффициентов,
приведенных в Табл. 4.2. Для этой цели удобно
воспользоваться частными производными 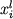 :
:
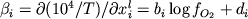 . (4.3) . (4.3)
В случае фосфора 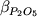 = d4
= 12.4418 > 0 (Табл. 4.2), т.е. увеличение
концентрации P2O5 в расплаве
приводит к возрастанию обратной
температуры или понижению температуры
кристаллизации магнетита. Этот эффект не
столь уж мал, т.к. добавление 1 мол.% P2O5
может понизить температуру кристаллизации
магнетита примерно на 20оС. = d4
= 12.4418 > 0 (Табл. 4.2), т.е. увеличение
концентрации P2O5 в расплаве
приводит к возрастанию обратной
температуры или понижению температуры
кристаллизации магнетита. Этот эффект не
столь уж мал, т.к. добавление 1 мол.% P2O5
может понизить температуру кристаллизации
магнетита примерно на 20оС.
Причины дестабилизирующего
влияния фосфора на устойчивость Mt уже
анализировались в литературе: прежде всего,
это возможность связывания части
трехвалентного железа в фосфатные
комплексы и понижение общего отношения Fe3+/Fe2+
в расплавах при увеличении концентрации P2O5
(Toplis et al., 1994ab). Дестабилизирующее
влияние на магнетит оказывает и
возрастание концентраций SiO2 и FeOобщ:
из данных Табл. 4.2 и уравнения
(4.3) следует,
что при logfO2 > -12 обе производные
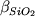 и и 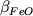 положительны. В отношении SiO2
этот результат выглядит естественно,
однако для FeOобщ может вызвать
некоторое недоумение. Кажется странным, что
стабильность железорудной фазы обратно
пропорциональна общему содержанию железа в
расплаве. Тем не менее, низкие стандартные
отклонения для параметров b3
и d3 (Табл.
4.2)
оставляют мало сомнений, что это
статистически обоснованное наблюдение.
Объяснение данному факту, по-видимому,
следует искать в структурно-химических и
окислительно-восстановительных реакциях с
участием ионов железа. Например, результаты
анализа экспериментальных исследований
зависимости отношения Fe3+/Fe2+ в
силикатных расплавах от состава также
показывают, что доля трехвалентного железа
понижается с увеличением общей
концентрации FeO (Борисов, Шапкин,
1989). положительны. В отношении SiO2
этот результат выглядит естественно,
однако для FeOобщ может вызвать
некоторое недоумение. Кажется странным, что
стабильность железорудной фазы обратно
пропорциональна общему содержанию железа в
расплаве. Тем не менее, низкие стандартные
отклонения для параметров b3
и d3 (Табл.
4.2)
оставляют мало сомнений, что это
статистически обоснованное наблюдение.
Объяснение данному факту, по-видимому,
следует искать в структурно-химических и
окислительно-восстановительных реакциях с
участием ионов железа. Например, результаты
анализа экспериментальных исследований
зависимости отношения Fe3+/Fe2+ в
силикатных расплавах от состава также
показывают, что доля трехвалентного железа
понижается с увеличением общей
концентрации FeO (Борисов, Шапкин,
1989).
Анализ уравнения (4.3) с
параметрами для TiO2
указывает на двойственность поведения
этого компонента: при logfO2 > -9,
добавление титана носит дестабилизирующий
характер; в более восстановительных
условиях - приводит к возрастанию
температуры кристаллизации
титаномагнетита, очевидно за счет
обогащения твердого раствора Ti-Mt
ульвошпинеливым компонентом.
Зависимость
температуры кристаллизации Mt от
fO2 по разному
проявляется в системах различного состава.
В соответствии с уравнением ликвидуса (4.2)
наиболее сильное влияние окислительно-восстановительных
условий можно ожидать для ферробазальтовых
составов, характеризующихся низкими и
умеренными содержаниями TiO2
и FeO (примерно до 2 и 15 мас.%,
соответственно). Для расплавов, обогащенных
TiO2 и FeO (типа
галапагосских толеитов),
данная зависимость может оказаться
довольно слабой. Иллюстрацией этого вывода
служат результаты, показанные на Рис.
4.12,
где приведены температуры ликвидуса
титаномагнетита, рассчитанные для 3-х
модельных составов (Табл. 4.3) в зависимости
от lоgfO2.
|

|
| Рис. 4.12.
Зависимости
температуры кристаллизации магнетита
от летучести кислорода, рассчитанные
по уравнению (4.2) для 2-х модельных
ферробазальтов и ферроандезита (Табл.
4.3)
|
Эти составы представляют условно
низко-Ti ферробазальт
(BAS-1), ферроандезит (AND) и высоко-Ti ферробазальт
(BAS-2). Для каждого из этих
составов по программе КОМАГМАТ
предварительно были оценены температуры
ликвидуса, которые соответствуют для
базальтов Ol-Pl котектикам (~ 1165 и ~ 1135о С),
а для андезита несколько пересыщенной
плагиоклазом системе с температурой
ликвидуса около 1125оС.
Таблица 4.3. Модельные
расплавы
|
Обр.
|
BAS-1
|
AND
|
BAS-2
|
|
SiO2
|
50.0
|
60.0
|
48.0
|
|
TiO2
|
2.0
|
0.5
|
4.0
|
| Al2O3 |
15.0
|
16.0
|
13.5
|
|
FeO
|
15.0
|
10.0
|
17.5
|
|
MnO
|
-
|
-
|
-
|
|
MgO
|
6.0
|
3.0
|
5.0
|
|
CaO
|
9.0
|
5.5
|
9.0
|
|
Na2O
|
2.5
|
3.5
|
2.5
|
|
K2O
|
0.5
|
1.5
|
0.5
|
|
P2O5
|
-
|
-
|
-
|
|
TPl,oC
|
1164
|
1126
|
1142
|
|
TOl,oC
|
1164
|
1094
|
1133
|
Эта величина примерно в 1.5 раза
ниже, чем оценено в работе (Toplis, Carroll,
1995), однако при этом надо учитывать, что в
отличии от данных авторов наши оценки
получены при условии неизменности состава
расплава. Не трудно видеть, что по
результатам расчетов понижение lоgfO2
от -6 до
-7 при переходе от
ферробазальта BAS-1 к
ферроандезиту эквивалентно понижению
магнетитового ликвидуса примерно на 35оС
(Рис. 4.12). Таким образом, предложенное
уравнение устойчивости магнетита
реалистично воспроизводит закономерности, установленные в опытах с
системами переменного состава.
В случае высокотитанистого
ферробазальта BAS-2 в
широком диапазоне летучести кислорода не
наблюдается насыщения системы
титаномагнетитом, поскольку расчетные
температуры варьируют около 1100оС, что
на 25-30оС ниже ликвидусной температуры
оливина и плагиоклаза. Очевидно, что при
кристаллизации в такого рода системе
температура первого появления Mt
буферируется составом и не будет сильно
отличаться от 1100оС, если не
произойдет существенного обогащения
расплава SiO2 или
обеднения титаном.
Несмотря на то, что эмпирическое
уравнение ликвидуса (4.2) полезно для общего
анализа влияния состава и fO2 на
температуру кристаллизации
титаномагнетита (Арискин,
1998),
существуют причины, которые не позволяют
использовать его при разработке моделей
равновесия Mt-расплав: (1) уравнение
ликвидуса было построено независимо от
состава магнетита, который помимо Fe2O3,
FeO и TiO2 обычно включает заметные
количества MgO и Al2O3; (2) в
результате применения МНК интегральный
эффект влияния состава оказался сильнее
зависимости от fO2.
Второе обстоятельство особенно
существенно: наши попытки интегрировать ур-е
(4.2) в КОМАГМАТ оказались неудачными, т.к.
приводили к чрезмерно сильному обеднению
расплава FeOобщ и обогащению SiO2,
чем следовало ожидать исходя из
зависимости температуры ликвидуса
магнетита от летучести кислорода (Рис.
4.12).
Это вызвало необходимость построения более
последовательной модели, основанной на
калибровке индивидуальных геотермометров Mt-расплав
для главных компонентов магнетитовых
твердых растворов (Ariskin, Barmina,
1999).
Для решения этой задачи из
базовой выборки составов, отвечающих
равновесию Mt-расплав (n=99), были
выбраны эксперименты, где имеются данные по
составам магнетитов - всего 74. В этой
выборке были введены дополнительные
ограничения на состав Ti-Mt (Cr2O3
< 3 мас.%) и расплава (46 < SiO2 < 70 мас.%,
P2O5 < 1.5 мас.%): этим критериям
отвечают данные 62 экспериментов. Новая
выборка составов была использована для
построения 5-ти эмпирических
геотермометров, описывающих распределение
ионов Fe3+, Fe2+, Ti4+, Al3+ и
Mg2+ между магнетитом и силикатной
жидкостью в зависимости от состава
расплава и летучести кислорода.
Учитывая, что железо и титан
входят в состав твердой фазы и при расчете
их концентраций в расплаве используется
содержание SiO2, мы исключили эти
компоненты из числа "независимых",
добавив в уравнение регрессии щелочи:
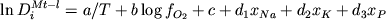 , (4.4) , (4.4)
где 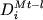 представляет мольные коэффициенты
распределения ионов Fe3+, Fe2+, Ti4+,
Al3+ и Mg2+ между Fe-Ti шпинелидом и
расплавом; xNa, xK и xP
- мольные доли Na, K и P в жидкости в пересчете
на однокатионный базис; a, b, c, d1,
d2 и d3 - регрессионные
коэффициенты. Отметим, что при расчетах "коэффициентов
распределения" Fe3+ и Fe2+ не
используются оценки концентраций этих
ионов в жидкости при помощи уравнений Сэка
или Килинка, а подставляются валовые
содержания железа в расплаве. С позиций
термодинамики этот подход
непоследователен, но имеет то преимущество,
что не вносит дополнительных погрешностей,
связанных с неопределенностью оценок Fe3+/Fe2+
и структурного состояния железа в расплаве.
Это предполагает, что интегральный эффект
редокс-реакций в расплаве учитывается
эмпирически как результат зависимости от logfO2,
щелочности и содержания фосфора. представляет мольные коэффициенты
распределения ионов Fe3+, Fe2+, Ti4+,
Al3+ и Mg2+ между Fe-Ti шпинелидом и
расплавом; xNa, xK и xP
- мольные доли Na, K и P в жидкости в пересчете
на однокатионный базис; a, b, c, d1,
d2 и d3 - регрессионные
коэффициенты. Отметим, что при расчетах "коэффициентов
распределения" Fe3+ и Fe2+ не
используются оценки концентраций этих
ионов в жидкости при помощи уравнений Сэка
или Килинка, а подставляются валовые
содержания железа в расплаве. С позиций
термодинамики этот подход
непоследователен, но имеет то преимущество,
что не вносит дополнительных погрешностей,
связанных с неопределенностью оценок Fe3+/Fe2+
и структурного состояния железа в расплаве.
Это предполагает, что интегральный эффект
редокс-реакций в расплаве учитывается
эмпирически как результат зависимости от logfO2,
щелочности и содержания фосфора.
Калибровка геотермометров
проводилась в две стадии. На первом
этапе обрабатывался полный ряд данных,
включающих 62 пары состава магнетита и
сосуществующего расплава. Затем полученные
регрессионные коэффициенты использовались
для решения обратной задачи - расчета
температуры равновесия Mt-расплав для
той же выборки при условии известных
фазовых составов и fO2. Если
отклонения модельных температур от экспериментальных
более чем в 3 раза превышали среднее
отклонение по выборке, то эти составы
рассматривались как "неравновесные" и
исключались из последующей обработки. Как
правило, для каждого компонента находилось
10-12 экспериментальных точек, для которых
температурные отклонения составляли 60-150oC.
Оставшиеся составы вновь обрабатывались по
методике МНК, а скорректированные таким
образом коэффициенты табулировались для
последующего моделирования (Табл.
4.4).
Подобная фильтрация данных может вызвать
сомнения в правомерности отбрасывания
части экспериментальной информации. Личный
опыт автора убеждает, онако, что этот подход
весьма эффективен в смысле повышения
точности геотермометров и адекватности
разрабатываемых моделей фазовых
равновесий.
Таблица 4.4.
Регрессионные коэффициенты для
геотермометров магнетит-расплав, калиброванных
по результатам экспериментов в сухих системах при давлении 1
атм
|
Компонент
|
a
|
b
|
c
|
d1
|
d2
|
d3
|
|
Fe3+ (n=50)
|
20964.7
(2075.6)
|
0.6159
(0.0252)
|
-8.8187
(1.4730)
|
-10.1838
(2.8384)
|
32.7525
(2.9031)
|
-14.2506
(4.3306)
|
|
Fe2+ (n=53)
|
17013.8
(1815.3)
|
0.1042
(0.0189)
|
-10.1728
(1.2499)
|
-1.5938
(2.6404)
|
14.1291
(2.4465)
|
-11.7925
(3.5610)
|
|
Al (n=51)
|
-17128.7
(2079.7)
|
0.0105
(0.0202)
|
11.5136
(1.4272)
|
-0.8377
(2.7046)
|
-4.8338
(2.4627)
|
5.8200
(3.6922)
|
|
Mg (n=52)
|
14971.4
(2370.5)
|
0.2021
(0.0255)
|
-8.2121
(1.6317)
|
-10.2151
(3.3928)
|
13.6451
(2.8096)
|
-25.1426
(4.6924)
|
|
Ti (n=43)
|
27422.6
(2325.7)
|
-0.1336
(0.0232)
|
-20.3655
(1.5963)
|
10.5126
(3.2761)
|
22.0278
(3.2829)
|
-10.3297
(4.0910)
|
Используя параметры
магнетитовых геотермометров из Табл.
4.4, мы
рассчитали температуры равновесия Mt-расплав
для урезанных выборок составов по каждому
из 5-ти компонентов. Точность
воспроизведения экспериментальных
температур варьировала при этом от 6.4оС
(Ti) до 15.6оС (Mg), составляя в среднем
около 10оС (Ariskin, Barmina,
1999). Эти
зависимости были использованы для
построения общей ЭВМ-модели равновесия Mt-расплав,
включающей 5 выбранных компонентов.
Новая магнетитовая модель
представляет автономную ЭВМ-программу,
позволяющую при известном составе расплава
и logfO2 рассчитывать не только
ликвидусную температуру, но также состав
титаномагнетита. В основе этой программы
лежит решение нелинейной системы уравнений,
включающей 5 геотермометров вида
(4.4) и
уравнение стехиометрии магнетита:
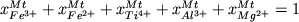 . (4.5) . (4.5)
Для решения этой системы
используется алгоритм, построенный по
методу последовательных итераций и в
главных деталях задействующий принципы
построения программы SPINMELT,
предназначенной для расчета равновесий
хромшпинелид-расплав (Ariskin, Nikolaev,
1996).
Тестирование новой магнетитовой модели
проведено на составах 32 экспериментальных
стекол, полученых в опытах
продолжительностью более 100 часов (Grove, Juster,
1989; Snyder et al., 1993; Toplis et al., 1994b; Toplis,
Carroll, 1995). Результаты этих расчетов
показаны на Рис. 4.13 и демонстрируют хорошую
воспроизводимость экспериментальных
данных. Это свидетельствует о
совместимости и внутренней
согласованности индивидуальных
геотермометров, использованных для
построения обобщенной модели равновесия
магнетит-расплав.
 |
|
Рис. 4.13.
Сравнение экспериментальных параметров
равновесия Mt-расплав с составами и
темпера-турами, рассчитанными при помощи
новой магнетитовой модели для известных
составов расплава и заданной летучести
кислорода.
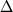 X(ср) и X(ср) и 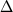 T(ср) представляют средние отклонения
расчетных значений от экспериментальных.
T(ср) представляют средние отклонения
расчетных значений от экспериментальных.
|
Так, модельные составы Mt
воспроизводят экспериментальные в среднем
с точностью 2.3 мол.% для Fe3+
и Fe2+, 0.5% для Al3+,
0.4% для Mg2+ и 1.3% для Ti4+;
при этом погрешности расчета общего
содержания железа в Mt (Fe3++Fe2+)
составляют около 1 мол.%. Экспериментальные
температуры воспроизводятся в пределах 10oC.
Новая модель равновесия Mt-расплав
интегрирована в программу КОМАГМАТ-3.5 и
тестирована на результатах независимого от
калибровок экспериментального
исследования (Ariskin, Barmina,
1999).
Hill and Roeder
(1974) представили
данные о стабильности магнетита в
зависимости от fO2 для природного
ферробазальта Gl-RHB, содержащего ~
13 мас.% FeO и 2% TiO2 при 51 мас.% SiO2. Эти
данные были получены при давлении 1 атм и
охватывают широкий диапазон летучести
кислорода -14 < logfO2 < -0.68. Мы
провели серию редокс-вычислений на этом
составе, используя новую версию программы КОМАГМАТ.
Как и в случае экспериментов, расчеты
проводились при фиксированных значениях logfO2
=-6, -7, -8, -9, и -10 с шагом кристаллизации 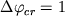 мол.%, от ликвидусной температуры до 1100oC.
Это позволило построить диаграмму фазовых
соотношений ферробазальта Gl-RHB в
зависимости от fO2 и температуры (Рис.
4.14).
мол.%, от ликвидусной температуры до 1100oC.
Это позволило построить диаграмму фазовых
соотношений ферробазальта Gl-RHB в
зависимости от fO2 и температуры (Рис.
4.14).
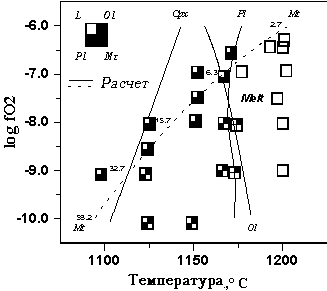 |
|
Рис. 4.14.
Сравнение экспериментальных и расчетных
минеральных парагенезисов, образованных
при равновесной кристаллизации ферробазальта
GL-RHB (Hill, Roeder,
1974)
Расчеты при помощи программы
КОМАГМАТ-3.5. Для минимизирования влияния
ошибок в расчете температур кристаллизации
Ol и Pl на стабильность магнетита, эти
температуры скорректированы: TOl увеличена
на 15оС, а TPl - на 10оС. Цифры
вдоль линии насыщения магнетитом
представляют значения Xulv в Mt,
рассчитанные по методу (Stormer,
1983).
|
Несмотря на то, что продолжительность
опытов (Hill, Roeder,
1974) составляла обычно 48
часов, данные Рис. 4.14 показывают хорошее
соответствие результатов расчетов и
экспериментов. Магнетит первым
кристаллизуется при fO2=10-6
бар и является 4-й фазой в
кристаллизационной последовательности при
fO2=10-9 бар. Модельные
температуры стабильности магнетита
отличаются от экспериментальных не более
чем на 10-15oC, что соответствует
точности разработанной модели равновесия Mt-расплав.
Интересно, что рассчитанная зависимость
ликвидуса магнетита от fO2 различается
в разных окислительно-восстановительных
условиях: в диапазоне -7<logfO2<-6
она составляет 30-35oC/logfO2 , а
при logfO2 < -10 не превышает 15oC/
logfO2.
Последующий опыт работы с этой
моделью показал , что наилучшим образом она
"работает" в диапазоне WM < fO2
< NNO. В более окислительных условиях
результаты расчетов могут переоценивать
температуру ликвидуса магнетита на 15-30oC.
Для учета этого фактора в программе КОМАГМАТ-3.5
предусмотрена автоматическая
корректировка расчетной температуры для Ti-Mt.
Дальнейшее развитие модели
фазовых равновесий связано с учетом
кристаллизации ильменита. В основном
разделе, посвященном калибровкам уравнений
равновесия минерал-расплав, отмечалось, что
в версии КОМАГМАТ-3.0 для моделирования
выделения ильменита были задействованы
уравнения (Nielsen, Dungan,
1983),
скорректированные на присутствие Fe2O3
(см. ур-е 2.44). Использование этих соотношений
приводило к недооценке ликвидусной
температуры Ilm на 20-30оС и его более
поздней кристаллизации.
Для разработки новой модели,
описывающей равновесия ильменита с
расплавами базальтов, была использована
такая же последовательность методических
приемов, как и для магнетита (Ariskin, Barmina,
1999). В начале был проведен глобальный поиск
по базе данных ИНФОРЭКС-4.0, в результате
которого было обнаружено 85 пар составов
сосуществующих ильменита и закалочных
стекол (Juster, Grove, 1989; Snyder et al., 1993; Auwera,
Longhi, 1994; Toplis et al., 1994b; Toplis, Carroll,
1995). Из этого ряда данных было исключено 10
экспериментов, где отсутствовали надежные
оценки летучести кислорода или Ilm имел
нестехиометрический состав (обычно
вследствие дефицита ионов Fe3+).
Оставшаяся выборка данных 75 экспериментов
была использована при последующих
калибровках.
Все эти опыты имели
продолжительность более 48 часов и
проведены в условиях контролируемой
фугитивности кислорода 10-13 < fO2
< 10-8 в диапазоне температур 1050-1150oC.
Большинство стекол варьируют по составу от
ферробазальтов до ферроандезитов при общей
щелочности (Na2O+K2O)<7 мас.%.
Математическая обработка этих данных
проводилась в две стадии на основе линейной
регрессии (4.2) для 5-ти катионов - Fe3+, Fe2+,
Ti4+, Al3+ и Mg2+. Регрессионные
коэффициенты к соответствующим уравнениям
равновесия приведены в Табл.
4.5.
Таблица 4.5.
Регрессионные коэффициенты для
геотермометров ильменит-расплав, калиброванных
по результатам экспериментов в сухих системах при давлении 1
атм
|
Компонент
|
a
|
b
|
c
|
d1
|
d2
|
d3
|
|
Fe3+ (n=65)
|
18933.4
(5796.2)
|
0.8475
(0.0469)
|
-8.6100
4.3982)
|
35.4214
(9.8997)
|
28.9571
(9.6089)
|
-8.6859
(7.4175)
|
|
Fe2+ (n=56)
|
2649.1
(903.4)
|
0.0544
(0.0084)
|
-0.4271
(0.6935)
|
-1.8146
(1.7981)
|
20.6115
(2.4139)
|
-1.7339
(1.3306)
|
|
Al (n=66)
|
-14947.7
(2436.5)
|
0.1778
(0.0204)
|
9.4357
(1.8763)
|
0.1175
(4.4802)
|
3.4801
(4.6040)
|
2.6951
(3.4255)
|
|
Mg (n=53)
|
904.8
(1044.4)
|
0.0340
(0.0087)
|
0.1111
(0.7864)
|
-1.6455
(1.7008)
|
14.3103
(1.6868)
|
-6.8648
(1.3100)
|
|
Ti (n=72)
|
12245.2
(974.7)
|
0.0178
(0.0080)
|
-6.6774
(0.7474)
|
5.8720
(1.8045)
|
25.2774
(1.7771)
|
-5.3331
(1.4075)
|
Примечание. В скобках указаны
стандартные отклонения (1 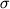 ). ).
Добавление в эту систему
геотермометров уравнения стехиометрии для Ilm
:
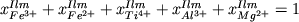 . (4.6) . (4.6)
легко решается относительно
температуры и состава твердой фазы при
известном составе расплава и летучести
кислорода.
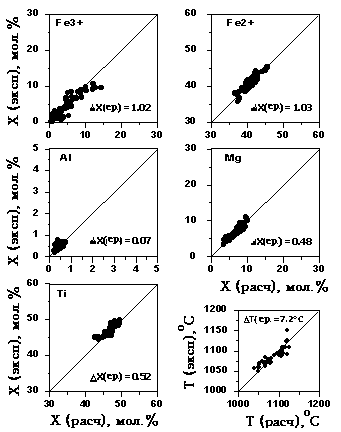
Для оценки точности новой "ильменитовой
модели" из базовой выборки составов были
выбраны данные 64 экспериментов
продолжительностью более 100 часов, которые
охватывают диапазон -12.6 < logfO2 <
-9. Результаты решения обратной задачи на
этой выборке показаны на Рис.
4.15. Эти
результаты демонстрируют высокую точность
расчета температур кристаллизации
ильменита, которая в среднем составляет
7.2oC. Модельные составы Ilm
отклоняются от экспериментальных с
погрешностями порядка 1 мол.% для Fe3+ и
Fe2+; для остальных компонентов средние
отклонения составов не превышают полпроцента:
0.07% (Al3+),
0.48% (Mg2+) и 0.52% (Ti4+).
 |
|
Рис. 4.15.
Сравнение экспериментальных параметров
равновесия Ilm-расплав с составами и
темпера-турами, рассчитанными при помощи
новой ильменитовой модели для известных
составов расплава и заданной летучести
кислорода.
D 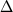 X(ср) и X(ср) и
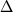 T(ср) представляют средние отклонения
расчетных значений от экспериментальных. T(ср) представляют средние отклонения
расчетных значений от экспериментальных.
|
Разработанная модель
кристаллизации ильменита была также
интегрирована в программу КОМАГМАТ-3.5,
которая теперь позволяет моделировать
сложные эффекты выделения Fe-Ti оксидов в
петрологически важном диапазоне летучести
кислорода, отвечающей интервалу буферных
равновесий примерно от IW до NNO.
Отметим, что в новой версии программы КОМАГМАТ
составы магнетита и ильменита выводятся в
форме катионных долей (Fe3+, Fe2+, Al3+,
Mg2+, Ti4+), а также в виде
параметров XUlv и XIlm,
которые рассчитываются по уравнениям Stormer
(1983).
На Рис. 4.16
 |
|
Рис. 4.16.
Фазовые диаграммы для ферробазальта SC1 (Табл.
4.1)
А Результаты
экспериментов по данным (Toplis,
Carroll, 1995, 1996). Б
Расчеты, проведенные при помощи программы
КОМАГМАТ-3.5. Для минимизирования влияния
ошибок в расчете температур кристаллизации
Ol и Pl на стабильность Fe-Ti оксидов, эти
температуры скорректированы: TOl увеличена
на 5оС, а TPl понижена на 15оС.
|
сопоставляются фазовые
диаграммы для синтетического
ферробазальта SC1 (Табл.
4.1), построенные
по результатам экспериментов (Toplis, Carroll,
1995, 1996) и данным расчетов с использованием
программы КОМАГМАТ-3.5. Фазовая
диаграмма на Рис. 4.16Б сконструирована
исходя из 17 траекторий равновесной
кристаллизации, рассчитанных в условиях fO2
параллельных буферу QFM для диапазона
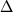 QFM от -2.5 до +1.5 с шагом 0.25 лог. ед. Она
интересна тем, что реалистично
воспроизводит изменение соотношений между
ильменитом и магнетитом вблизи буфера QFM.
(преобладание Mt в более окислительных
условиях и относительно раннее выделение Ilm
в восстановительных). При этом ошибки
определения полей устойчивости магнетита и
ильменита составляют порядка 10-12oC. QFM от -2.5 до +1.5 с шагом 0.25 лог. ед. Она
интересна тем, что реалистично
воспроизводит изменение соотношений между
ильменитом и магнетитом вблизи буфера QFM.
(преобладание Mt в более окислительных
условиях и относительно раннее выделение Ilm
в восстановительных). При этом ошибки
определения полей устойчивости магнетита и
ильменита составляют порядка 10-12oC.
Результаты этих расчетов дают
важную информацию по пропорциям
кристаллизации оксидов: в точке появления Mt
на ликвидусе она составляет 35-40 мас.%, что
согласуется с данными (Hill, Roeder, 1974; Toplis,
Carroll, 1996), однако для основного интервала
кристаллизации ассоциации Ol+Pl
Aug+Mt, варьирует в пределах 16-22%. Модельная
пропорция ильменита более постоянна и
колеблется от 8 до 14 мас.%.
Примечание:
19 При наличии состава шпинели отбирались фазы с суммарным содержанием оксидов железа и титана не менее 85% и концентрацией Cr2O3 не более 5%. При отсутствии таких данных отнесение шпинели к титаномагнетиту проводилось на основании описаний авторов.
Назад | Оглавление|
Далее
|

