Бычков А.Ю.
Москва, ГЕОС, 2009 год, 124 страницы.
ISBN 978-5-89118-453-4
|
Содержание книги |
5.1. Исходные термодинамические данные
Термодинамические свойства минералов и других компонентов во многом определяют качество модели в области описания физико-химических равновесий. Описание водного раствора как смеси различных форм - ионов, молекул или комплексных соединений - является общепринятым подходом и позволяет избежать учета неидеальности смешения в виде больших коэффициентов активности. Однако это требует правильного учета всех возможных форм, что ограничивается экспериментальной изученностью системы.
Для модели была выбрана 12-компонентная система (H-C-O-N-Na-Cl-S-Si-Hg-As-Sb-Fe), содержащая минералы, газовый и водный растворы. Список учтенных соединений приведен в табл. 5.1.
| Таблица 5.1. Опорные значения приведенных свободных энергий образования goT газов, минералов и частиц водного раствора (кДж/моль) |
| Температура, oС |
| 25 | 50 | 60 | 70 | 80 | 90 | 100 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Газы
| | Метан | -50,708 | -55,401 | -57,298 | -59,206 | -61,126 | -63,055 | -64,996
| | H2 | 0 | -3,296 | -4,631 | -5,974 | -7,326 | -8,686 | -10,054
| | H2O, gas | -228,57 | -233,325 | -235,246 | -237,176 | -239,117 | -241,067 | -243,027
| | O2 | 0 | -5,159 | -7,238 | -9,327 | -11,424 | -13,53 | -15,643
| | S | 236,55 | 232,328 | 230,625 | 228,915 | 227,197 | 225,472 | 223,74
| | SO2 | -300,095 | -306,329 | -308,84 | -311,36 | -313,89 | -316,429 | -318,979
| | H2S | -33,431 | -38,608 | -40,697 | -42,797 | -44,907 | -47,027 | -49,157
| | H2S6 | -10,398 | -20,797 | -24,956 | -29,115 | -33,275 | -37,434 | -41,594
| | COS | -168,914 | -174,737 | -177,084 | -179,442 | -181,811 | -184,19 | -186,58
| | N2 | 0 | -4,82 | -6,764 | -8,717 | -10,678 | -12,647 | -14,625
| | CO2 | -394,374 | -399,757 | -401,932 | -404,118 | -406,316 | -408,526 | -410,747
| | HCl | -95,297 | -99,997 | -101,892 | -103,795 | -105,706 | -107,624 | -109,551
| | Hg | 30,482 | 26,089 | 24,32 | 22,545 | 20,764 | 18,976 | 17,184
| | Минералы
| | Сера | 2,8 | 1,975 | 1,632 | 1,283 | 0,926 | 0,562 | 0,187
| | Ртуть | 0 | -1,926 | -2,712 | -3,506 | -4,308 | -5,118 | -5,935
| | Мышьяк | 0 | -0,917 | -1,298 | -1,686 | -2,082 | -2,484 | -2,894
| | Кварц | -856,227 | -857,307 | -857,764 | -858,237 | -858,723 | -859,223 | -859,738
| | Арсенолит | -588,27 | -591,287 | -592,548 | -593,84 | -595,163 | -596,516 | -597,9
| | Пирит | -159,535 | -160,922 | -161,513 | -162,122 | -162,751 | -163,399 | -164,065
| | Киноварь | -51,381 | -53,492 | -54,365 | -55,252 | -56,154 | -57,071 | -58,002
| | Реальгар | -132,72 | -139,053 | -141,693 | -144,391 | -147,146 | -149,958 | -152,824
| | Аурипигмент | -91,47 | -95,673 | -97,419 | -99,199 | -101,014 | -102,863 | -104,744
| | Арсенопирит | -109,621 | -112,406 | -113,561 | -114,739 | -115,939 | -117,16 | -118,402
| | Антимонит | -149,3 | -153,973 | -155,908 | -157,88 | -159,887 | -161,929 | -164,005
| | Водный раствор
| | H2O | -237,141 | -238,966 | -239,738 | -240,532 | -241,349 | -242,186 | -243,085
| | H+ | 0 | 0 | 0 | 0 | 0 | 0 | 0
| | OH- | -157,262 | -156,843 | -156,615 | -156,359 | -156,221 | -156,077 | -155,769
| | CO3-- | -527,983 | -526,462 | -525,72 | -524,907 | -524,476 | -524,028 | -523,082
| | HCO3- | -586,94 | -589,372 | -590,332 | -591,286 | -591,76 | -592,233 | -593,173
| | H2CO3 (aq) | -623,115 | -628,113 | -630,273 | -632,515 | -633,666 | -634,836 | -637,234
| | H3SiO4- | -1251,61 | -1254,18 | -1255,12 | -1256,05 | -1256,51 | -1256,97 | -1257,9
| | H4SiO4 (aq) | -1307,69 | -1312,98 | -1315,1 | -1317,24 | -1318,32 | -1319,4 | -1321,61
| | N2 (aq) | 18,188 | 15,567 | 14,404 | 13,182 | 12,549 | 11,903 | 10,571
| | HAsO4-- | -714,585 | -714,343 | -714,146 | -713,896 | -713,753 | -713,597 | -713,246
| | H2AsO4- | -753,162 | -756,092 | -757,266 | -758,442 | -759,03 | -759,619 | -760,795
| | H2AsO3- | -587,141 | -589,895 | -590,995 | -592,093 | -592,642 | -593,191 | -594,287
| | H3AsO3 | -646,503 | -651,879 | -654,145 | -656,47 | -657,654 | -658,851 | -661,285
| | As2S4-- | -21,708 | -26,341 | -27,932 | -29,378 | -30,047 | -30,681 | -31,841
| | HAs2S4- | -70,34 | -75,999 | -78,046 | -79,972 | -80,89 | -81,778 | -83,462
| | HAs2S3O | -292,96 | -298,786 | -300,982 | -303,102 | -304,132 | -305,143 | -307,105
| | O2 (aq) | 16,544 | 13,594 | 12,3 | 10,946 | 10,248 | 9,536 | 8,072
| | H2 (aq) | 17,723 | 16,118 | 15,392 | 14,624 | 14,224 | 13,814 | 12,964
| | H2S (aq) | -27,92 | -31,233 | -32,649 | -34,112 | -34,86 | -35,62 | -37,171
| | H2S2 (aq) | -6,066 | -8,534 | -9,408 | -10,234 | -10,631 | -11,018 | -11,764
| | H2S3 (aq) | 4,116 | 1,222 | 0,11 | -0,979 | -1,514 | -2,043 | -3,083
| | H2S4 (aq) | 8,646 | 5,148 | 3,796 | 2,469 | 1,815 | 1,167 | -0,111
| | H2S5 (aq) | 10,893 | 6,658 | 5,007 | 3,38 | 2,574 | 1,774 | 0,192
| | HS- | 11,966 | 10,348 | 9,744 | 9,162 | 8,88 | 8,602 | 8,064
| | HS2- | 22,074 | 20,717 | 20,337 | 20,031 | 19,903 | 19,791 | 19,611
| | HS3- | 28,603 | 26,442 | 25,656 | 24,911 | 24,553 | 24,205 | 23,539
| | HS4- | 31,021 | 28,079 | 26,974 | 25,907 | 25,387 | 24,876 | 23,882
| | HS5- | 31,327 | 27,537 | 26,084 | 24,664 | 23,966 | 23,276 | 21,921
| | S2-- | 79,496 | 79,25 | 79,364 | 79,577 | 79,718 | 79,881 | 80,268
| | S3-- | 73,638 | 72,211 | 71,751 | 71,349 | 71,168 | 71,002 | 70,71
| | S4-- | 69,036 | 66,649 | 65,791 | 64,984 | 64,598 | 64,225 | 63,514
| | S5-- | 65,689 | 62,343 | 61,087 | 59,875 | 59,285 | 58,705 | 57,577
| | S (aq) | 36,011 | 33,07 | 31,869 | 30,647 | 30,027 | 29,4 | 28,125
| | S2O3-- | -522,582 | -524,033 | -524,503 | -524,916 | -525,102 | -525,275 | -525,579
| | SO3-- | -486,599 | -485,57 | -485,011 | -484,377 | -484,032 | -483,669 | -482,89
| | HSO3- | -527,728 | -531,22 | -532,618 | -534,017 | -534,717 | -535,416 | -536,815
| | SO4-- | -744,459 | -744,684 | -744,654 | -744,564 | -744,496 | -744,415 | -744,208
| | HSO4- | -755,59 | -758,89 | -760,228 | -761,576 | -762,253 | -762,931 | -764,294
| | Cl- | -131,29 | -132,591 | -133,052 | -133,481 | -133,684 | -133,879 | -134,246
| | HCl (aq) | -126,153 | -128,791 | -129,847 | -130,902 | -131,428 | -131,955 | -133,005
| | Na+ | -261,881 | -263,384 | -264,011 | -264,654 | -264,98 | -265,31 | -265,982
| | NaOH (aq) | -418,001 | -420,09 | -420,936 | -421,792 | -422,224 | -422,658 | -423,534
| | NaCO3- | -795,001 | -796,637 | -797,257 | -797,86 | -798,155 | -798,446 | -799,015
| | NaHCO3 (aq) | -847,736 | -852,405 | -854,318 | -856,257 | -857,235 | -858,22 | -860,206
| | NaSO4- | -1010,34 | -1013,06 | -1014,11 | -1015,13 | -1015,63 | -1016,12 | -1017,1
| | NaCl (aq) | -378,615 | -382,531 | -384,113 | -385,704 | -386,502 | -387,303 | -388,908
| | Sb(OH)2+ | -416,155 | -418,082 | -418,931 | -419,817 | -420,274 | -420,739 | -421,692
| | Sb(OH)3 (aq) | -643,625 | -648,17 | -650,142 | -652,193 | -653,247 | -654,319 | -656,514
| | Sb(OH)4- | -812,76 | -817 | -818,797 | -820,646 | -821,59 | -822,546 | -824,492
| | HSb2S4- | -295,811 | -302,236 | -304,777 | -307,291 | -308,537 | -309,774 | -312,221
| | Sb2S4-- | -54,423 | -60,151 | -62,381 | -64,569 | -65,646 | -66,711 | -68,802
| | Fe++ | -91,504 | -88,831 | -87,749 | -86,662 | -86,115 | -85,568 | -84,467
| | FeOH+ | -274,452 | -273,718 | -273,46 | -273,22 | -273,107 | -272,998 | -272,793
| | Fe(OH)2 (aq) | -448,267 | -449,154 | -449,575 | -450,033 | -450,276 | -450,527 | -451,055
| | Fe(OH)3- | -614,206 | -615,366 | -615,868 | -616,395 | -616,667 | -616,945 | -617,519
| | FeSO4 (aq) | -848,521 | -849,183 | -849,456 | -849,732 | -849,872 | -850,011 | -850,292
| | FeCl+ | -221,555 | -221,241 | -221,09 | -220,926 | -220,839 | -220,748 | -220,555
| | FeCl2 (aq) | -326,663 | -329,413 | -330,509 | -331,599 | -332,142 | -332,682 | -333,757
| | Fe+++ | -17,238 | -10,172 | -7,281 | -4,356 | -2,881 | -1,398 | 1,594
| | FeOH++ | -241,911 | -238,758 | -237,567 | -236,413 | -235,848 | -235,292 | -234,203
| | Fe(OH)2+ | -459,22 | -459,314 | -459,527 | -459,831 | -460,016 | -460,222 | -460,696
| | Fe(OH)3 (aq) | -672,249 | -673,518 | -674,213 | -675,008 | -675,441 | -675,897 | -676,877
| | Fe(OH)4- | -842,639 | -844,26 | -845,071 | -845,97 | -846,452 | -846,954 | -848,019
| | FeCl++ | -158,745 | -155,022 | -153,5 | -151,959 | -151,181 | -150,398 | -148,816
| | CH4 (aq) | -34,451 | -36,913 | -38,032 | -39,221 | -39,839 | -40,474 | -41,791
| | Hg (aq) | 35,89 | 39,543 | 40,806 | 41,969 | 43,038 | 44,019 | 44,869
| | Hg2Cl2 (aq) | -179,373 | -184,6 | -186,628 | -188,623 | -190,583 | -192,507 | -194,395
| | HgCl+ | -4,736 | -7,158 | -8,165 | -9,191 | -10,233 | -11,289 | -12,358
| | HgCl2 (aq) | -173,008 | -178,463 | -180,702 | -182,968 | -185,256 | -187,565 | -189,89
| | HgCl3- | -309,006 | -316,325 | -319,275 | -322,233 | -325,194 | -328,157 | -331,118
| | HgOH- | -53,084 | -54,28 | -54,82 | -55,392 | -55,996 | -56,63 | -57,292
| | Hg(OH)2 aq | -275,474 | -278,627 | -279,997 | -281,426 | -282,911 | -284,45 | -286,04
| | Hg(HS)2 | -18,464 | -24,138 | -26,479 | -28,856 | -31,265 | -33,703 | -36,168
| | HgHS2- | 8,659 | 3,653 | 1,608 | -0,457 | -2,54 | -4,638 | -6,749
| | HgS2-- | 12,951 | 6,167 | 3,332 | 0,435 | -2,517 | -5,523 | -8,578
|
Для расчета значений goT при разных температурах использовали базу термодинамических данных UNITHERM (автор - Ю.В. Шваров). В ней предусмотрены два способа расчета свойств частиц водного раствора: по модели Хельгесона [Johnson et al., 1992] и для комплексных соединений через константы диссоциации по уравнению Рыженко-Брызгалина-Рафальского [Рыженко, 1981; Борисов, Шваров, 1982].
| pKoдис(T, p) = (298,15/T).pKoдис(298,15; 1) + B(T, p)(zz/a)эфф, |
(5.1) |
где B(T,p) - функция, определенная по зависимости константы диссоциации воды от давления и температуры; (zz/a)эфф - эмпирический параметр электростатического взаимодействия в комплексном соединении. Этот способ предпочтительнее в тех случаях, когда экспериментальных данных недостаточно для вычисления всех параметров модели Хельгесона. В случае полного отсутствия высокотемпературных экспериментальных данных он позволяет с хорошей точностью предсказать свойства частицы по единственному значению pKoдис путем теоретической оценки параметра (zz/a)эфф [Брызгалин, Рафальский, 1982]. Расчет goT в этом случае производится через константу диссоциации и энергии участвующих в реакции базисных ионов.
Расчет энергии базисных ионов осуществляется по модели HKF SUPCRT92 [Johnson et al., 1992]. Если параметры этой модели для некоторых частиц неизвестны, их же можно определить из экспериментальных работ различными способами [Акинфиев, 1994; Бычков, Гричук, 1988].
Для основной части системы специальной работы по подбору и уточнению термодинамических данных не проводили. Значения энергии образования компонентов взяты из базы UNITHERM, в которую они собраны из различных источников [Термодинамические..., 1978-1981; Наумов и др., 1971] Д.В. Гричуком и М.В. Борисовым [Методы..., 1988; Борисов, Шваров, 1992]. Поскольку в этой базе отсутствовали параметры для расчета свойств для водорастворимых форм мышьяка, сурьмы, ртути и некоторых форм серы, потребовалось специальное исследование по подбору и критическому анализу литературных данных. Работу сильно облегчило наличие нескольких обзорных работ по свойствам As, Sb и Hg в водных растворах [Шикина и др., 1982; Сорокин и др., 1988; Акинфиев и др., 1993; Акинфиев, Зотов, 1992].
SbIII-H2O-H2S. Изучение форм нахождения сурьмы (III) в водных растворах проводили многие авторы. В растворах, не содержащих сероводород, определены гидроксокомплексы: Sb(OH)2+, Sb(OH)3o, Sb(OH)4- [Шикина, Зотов, 1990]. По растворимости оксида сурьмы
| Sb2O3 кр + 3H2O = 2Sb(OH)3oр-р |
(5.2) |
получены достаточно надежные значения энергии образования нейтрального комплекса, который весьма устойчив и преобладает в широком интервале рН. Позднее Н.Н. Акинфиев И А.В. Зотов получили параметры модели HKF для этой формы [Акинфиев, Зотов, 1993]. Надежно известные энергии образования всех веществ в реакции (5.2) позволяют использовать эту частицу в качестве базисной. По модели HKF рассчитываются goT. Для остальных гидроксокомплексов данных не так много, поэтому по данным для разных температур из работы [Шикина, Зотов, 1990] вычислен параметр уравнения Рыженко (zz/a)эфф для реакций:
| Sb(OH)3oр-р = Sb(OH)2+ + OH-, |
(5.3) |
| Sb(OH)4- = Sb(OH)3- + OH-. |
(5.4) |
Термодинамические свойства минералов сурьмы: антимонита, сенармонтита и валентинита были приняты по значениям, рекомендованным Н.Н. Акинфиевым и А.В. Зотовым [1993]. В литературе значения энтальпии образования антимонита сильно различаются [Наумов и др., 1971; Столярова, Колпакова, 1978; Johnson et al., 1981; некрасов и др., 1982]. Если в энергии образования антимонита содержится систематическая ошибка, это может повлиять на выводы об относительной устойчивости гидроксокомплексов (данные о которых получены по растворимости оксидов) и сульфидных комплексов (изученных по растворимости антимонита). Поэтому важно было оценить качество описания растворимости антимонита в малосульфидных растворах. Для этого был выбран независимый эксперимент Вуда с соавт. [Wood et al., 1987], который не был использован для получения термодинамических данных из-за сложности изучавшейся системы. Эти авторы исследовали растворимость сложной смеси минералов (пирит-пирротин-магнетит-сфалерит-галенит-золото-антимонит-висмутин-аргентит-молибденит при температурах 200-350oС и разных концентрациях NaCl и CO2. Активность сероводорода в растворе задавали минеральным буфером пирит-пирротин-магнетит. Растворимость антимонита определяется реакцией:
| Sb2O3 кр + 6H2O = 2Sb(OH)3oр-р + 3H2Soр-р. |
(5.5) |
Результаты численного моделирования показали, что предложенные в работе [Шикина, Зотов, 1990] термодинамические свойства комплекса Sb(OH)3oр-р позволяют описать растворимость антимонита в эксперименте [Wood et al., 1987] с погрешностью 25-30%. Это может свидетельствовать о том, что существует согласие между энергиями образования антимонита и Sb(OH)3oр-р при температурах 200-350oС.
В литературе на сегодняшний день нет единого мнения о формах сурьмы в растворах сульфидной серы, несмотря на то что объем экспериментальных данных достаточно велик. Это объясняется двумя причинами: 1) антимонит в экспериментах плохо кристаллизуется и зачастую в опытах достигается равновесие с другими, метастабильными фазами; 2) сложность независимого задания pH и концентрации сульфидной серы.
В ранних работах предполагалось наличие в растворах комплексов типа H3SbHS3o; H2SbS3-; SbS33- [Arntson et al., 1966; Brookins, 1972, 1986] и SbS2- [Wood, 1989]. В некоторых работах предполагалось наличие смешанных гидроксосульфидных комплексов: Sb(HS)2(OH)2- [Бабко, Лисецкая, 1956]; SbS(OH)2-; SbS2(OH) [Овчинников и др., 1981; 1982]. Н.Н. Колпакова [1971] переинтерпретировала данные некоторых ранних работ и показала, что большее число данных по растворимости антимонита можно объяснить образованием в растворе частиц H2Sb2S4o, HSb2S4-, Sb2S42-. Позднее Н.Н. Колпакова, А.А. Конюшок и В.И. Сорокин получили термодинамические константы этих комплексов в широком интервале условий [Сорокин и др., 1988]. Работа Р. Круппа [Krupp, 1988] в целом подтвердила эту схему комплексообразования, но растворимость антимонита в кислых растворах он интерпретировал как реакцию
| Sb2O3 кр + 2H2O = Sb2S2(OH)2oр-р + H2Soр-р. |
(5.6) |
по зависимости растворимости от рН и концентрации сульфидной серы. Однако большой экспериментальный разброс значений не позволяет выбрать решение между реакциями (5.5) и (5.6). Использование энергии комплекса Sb(OH)3o [Шикина, Зотов, 1990] позволяет описать растворимость антимонита с погрешностью ±50% в экспериментах Р. Круппа в той области, где им предполагалось образование гидроксосульфидного комплекса. Н.Н. Акинфиев и А.В. Зотов [Акинфиев и др., 1993] переинтерпретировали эксперимент Р. Круппа и на этой основе согласовали термодинамические данные для комплексов сурьмы в водном растворе. Эти авторы вычислили параметры модели Хельгесона для сульфидных комплексов сурьмы: H2Sb2S4o, HSb2S4-, Sb2S42- и уточнили их для Sb(OH)3o. Результаты согласования были приняты как исходные термодинамические данные для расчетов равновесий. Погрешность расчета растворимости антимонита с использованием этих данных при температуре 100 oС вряд ли может превышать 0,5 лог.ед., поскольку опирается на эксперимент С. Вуда, проведенный в близких условиях.
AsIII-H2O-H2S. Свойства минералов мышьяка и комплексов в водном растворе приняты по работе [Акинфиев, Зотов, 1992], где данные в этой системе взаимосвязаны. По данным авторов, расчетная растворимость аурипигмента с использованием рекомендованных ими величин согласуется с результатами экспериментов [Миронова, Зотов, 1980; Миронова и др., 1983, 1990] в пределах 0,3 лог.ед., что лежит в пределах экспериментального разброса. В литературе полностью отсутствуют определения свойств алакранита и узонита. Значения энтальпии для аморфных фаз близкого состава [Johnson et al., 1980] не могут служить для оценки свойств этих минералов и потому в модели эти фазы не учитывались.
Hg-H2O-H2S-Cl. Значения goT для ионов ртути Hg2+, Hg22+ приняты по модели Хельгесона [Johnson et al., 1992]. Константы диссоциации комплексов ртути приняты по значениям, рекомендованным в работах [Шикина и др., 1979, 1982, 1985; Dickson, 1964; Белеванцев и др., 1971, 1977, 1982; Ефремова и др., 1982]. Энергии Hgoaq и Hgгаз приняты по [Сорокин и др., 1988; гущина и др., 1993; Ходаковский и др., 1977]. Для того чтобы получить возможность рассчитать свойства частицы Hgoaq в базе UNITHERM для нее были определены параметры модели HKF. Для определения параметров обработаны данные по 127 экспериментальным точкам разных авторов, приведенным в работах [Сорокин и др., 1978, 1988]. Параметры модели HKF рассчитывали методом наименьших квадратов по программе UT-HEL с использованием эмпирических закономерностей [Tanger, Helgeson, 1988; Shock, Helgeson, 1988]. Теплоемкость, энтальпия и энтропия газообразной ртути взяты по работе [Вукалович и др., 1971].
S-H2O-H2S. Значения goT для кислородных форм серы в водных растворах (SO42-, HSO4-, H2SO3o, HSO3-, SO32-, HS2O3-) приняты по модели Хельгесона [Johnson et al., 1992] и константам диссоциации, рекомендованным в работе [Murray, Cibiccotti, 1983]. Использование этих данных позволяет описать растворимость элементарной серы в воде при температурах выше 200 oС [Лаптев и др., 1987; Ellis, Giggenbach, 1971; Сорокин и др., 1986; Кушнир, 1989; Колонин и др., 1982; Рафальский и др., 1983]. Помимо этих форм, в модели учтены полисульфаны, играющие весьма важную роль в узонских гидротермах [Мигдисов и др., 1991].
Для полисульфид-ионов параметры модели Хельгесона взяты из базы SUPCRT92, где они вычислены из данных [Maronny, 1959; Boulege, 1976, 1977, 1978; Boulege, Michard, 1973, 1977, 1978; Giggenbach, 1972, 1974, 1980]. Для полисульфанов, то есть недиссоциировнных частиц H2Sn и HSn-, известны только константы диссоциации при 25 oС. В последних работах Арт.А. Мигдисова [Мигдисов, 1992; Migdisov, Alekhin, 1993] определены первая и вторая константы диссоциации для второго полисульфана H2Sn при температурах 25, 50, 70, 90 oС. По этим данным методом наименьших квадратов был определен параметр (zz/a)эфф.
Для прочих полисульфанов этот параметр определяли эмпирически, приняв при этом схему строения молекулы полисульфана по [Murowchik, Barnes, 1986]. Согласно этой схеме, заряд равномерно располагается по длине цепочки полисульфидной серы. Соответственно, свойства полисульфанов оказались линейно зависящими от 1/n [Schoonen, Barnes, 1988; Williamson, Rimstidt, 1992].
Энергию образования полисульфана H2S6 в газовой фазе вычислялиы по работам Арт.А. Мигдисова [1991], а также [Migdisov et al., 1998].
Опорные значения величины свободных энергий образования приведены в таблице 5.1.
5.2. Кинетические ограничения термодинамической модели
Хорошо известно, что некоторые химические равновесия устанавливаются весьма медленно, причем при низких температурах скорость реакции может быть такой низкой, что говорят о "замороженном" равновесии. Если в термодинамической модели производится расчет таких равновесий вместе с теми реакциями, которые протекают быстро, то модель не будет отвечать свойствам природного объекта. В кипящих системах, где быстрые процессы перераспределения газ-жидкость управляют многими равновесиями, это особенно важно. Для правильного описания химических реакций, особенно в низкотемпературной системе необходимо рассмотреть их кинетические характеристики [Волков, Рузайкин, 1974; Рафальский, 1973, 1983].
Как учесть в термодинамической модели, основанной на расчетах химического равновесия кинетические ограничения? В общем случае этого сделать нельзя. Однако реакции, скорость которых так мала, что за время установления других равновесий количества прореагировавших веществ ничтожно мало, можно описать как отсутствие равновесия. Как правило, в термодинамических системах можно выделить определенные компоненты, для которых отсутствует равновесие. При температуре 100oС и ниже такими компонентами будут: шестивалентная сера, углеводороды, возможно, молекулярный водород.
Предварительные расчеты показали, что в условиях подрудной зоны гидротермальный раствор неравновесен с газовой фазой по парам СН4-СО2 и H2S-SO42-. В равновесном состоянии концентрация СН4 должна быть гораздо выше, а H2S и H2 - гораздо ниже реально наблюдаемой. Отсутствие равновесия в природных условиях легко объяснимо в свете известных данных о медленном установлении равновесия в таких окислительно-восстановительных реакциях [Алексеев и др., 1984]. В то же время эти компоненты легко могут участвовать в реакциях других типов (комплексообразования и диссоциации, перераспределения между жидкостью и газом), что необходимо учесть в модели. Для описания таких метастабильных состояний по сере использовали два независимых компонента - S и S* [Методы..., 1988]. Шестивалентную (сульфатная) серу задавали в исходном составе системы как S*, а все другие формы серы - как S, и восстановление сульфатов становилось невозможным. Для расчета полного равновесия все формы серы суммировали в один независимый компонент S. Аналогично поступали и с СН4.
При расчетах метан был принят неравновесным с другими компонентами системы во всех моделях, а сульфатная сера - в моделях кипения и смешения. В модели окисления постулировалось равновесие между формами серы, причины и результаты этого обсуждаются ниже.
Реакция между газообразными водородом и кислородом требует преодоления кинетического барьера и также устанавливается крайне медленно. В газах гидротерм постоянно фиксируются 0,2-1,0% кислорода и примерно эквивалентные количества водорода. Предварительные расчеты показали, что если бы равновесие достигалось, они должны были прореагировать с образованием воды. В модели элементарный кислород не вводили в состав системы.
В литературе имеются данные, что молекулярный водород из-за кинетических ограничений не восстанавливает элементарную серу в сухой системе вплоть до 200oС [Малинин, Хитаров, 1969]. Измерения окислительно-восстановительного потенциала всегда имеют более высокие значения, чем оцененные по парциальному давлению водорода. Предварительные расчеты показали, что если бы газообразный водород был равновесен с минералами мышьяка, то устойчивой фазой был бы самородный мышьяк, а не реальгар, как это наблюдается на Узоне, что совпадает со сделанными ранее выводами В.И. Сорокина [Сорокин и др., 1986, 1988; Сергеева и др., 1971].
Другая проблема, связанная с кинетическими ограничениями, - взаимодействие вода-порода в зоне рудообразования. В зоне рудообразования происходят процессы аргиллизации, которые могут изменять состав растворов; минеральные парагенезисы могут определять некоторые параметры, например, рН. Исследования шлифов показали, что во вмещающих породах не происходит полного замещения первичных минералов, и даже стекла. Во всех зонах встречены обломки, в которых аргиллизация развита очень слабо. При этом соотношение порода/вода в гравелитах весьма велико. При открытой пористости 15-20% [Кошемчук, 1993] количества раствора, только насыщающего рудный горизонт, достаточно для полного изменения стекла и первичных минералов пород. Это свидетельствует о том, что взаимодействие порода-вода происходит медленно, а при построении модели правильнее пренебречь ими. Это соответствует выводам большинства других исследователей Узона [Алехин и др., 1987].
Для зоны рудообразования на Узоне характерны тонкодисперсные и коллоидные фазы. Поверхность фаз характеризуется избыточной свободной энергией образования, и для правильного описания равновесий с участием таких фаз необходимо это учитывать. В модели можно задать goT индивидуальной дисперсной фазы как
goT дисп = goT кр + ΔGпов,
где ΔGпов - свободная энергия образования поверхности 1 моля фазы. Эта величина зависит от очень многих параметров и может быть оценена лишь эмпирически. На основании исследований форм серы в растворах Узона Арт.А. Мигдисов показал, что наилучшим образом их можно описать равновесием с коллоидной серой с избыточной поверхностной энергией 1,8-2,5 кДж/моль [Мигдисов и др., 1991]. Более высокие (до 3,5 кДж/моль) значения для свежеобразованных осадков серы получены в экспериментах [Мигдисов, 1992]. Аналогичные значения рекомендованы Булегом [Boulegue, 1978] для анализа равновесий с участием коллоида серы. По данным потенциометрических исследований, были получены значения 2,5-3,5 кДж/моль в зависимости от температуры. Таким образом, для серы оценки, выполненные разными методами, дают сходные результаты, и эти значения могут быть рекомендованы для учета в модели.
5.3. Модель кипения
Чтобы рассчитать термодинамическую модель для концептуальных геологических моделей, изложенных выше (см. гл. 4), необходимо алгоритмизировать их в понятиях программы, по которой этот расчет проводится. Для расчетов равновесий мы использована программа HCh (разработка Ю.В. Шварова) для IBM-совместимых компьютеров. Эта программа позволяет рассчитывать равновесие в мультисистеме, содержащей газовый и водный растворы и произвольное количество твердых фаз [Шваров, 1982]. Алгоритмизация заключается в определении последовательности таких систем и их независимых параметров: T, p, масс инертных компонентов.
Количество компонентов в системе задавали через сумму составов растворов (табл. 4.1) и газа (табл. 4.2) в пропорции, определяемой газовым фактором G/L. В этом случае газовый фактор выполняет роль дополнительного параметра модели. Поскольку его значение точно не определено для Рудного Поля, рассчитана серия составов с G/L = 0,01; 0,1; 0,3; 1; 2; 10. Рудные элементы вводили в систему в избытке, но не более 10-4 моль/кг в виде минералов. Таким образом была рассчитана растворимость рудных минералов, что позволило избежать неопределенности в содержании этих компонентов в глубинном растворе. Так можно поступать, когда рудные компоненты выступают как микроэлементы, то есть их поведение существенно не влияет на другие параметры системы, что достигается при низких растворимостях - < 10-4 моль/кг. Если расчетные значения превосходили этот предел, концентрация насыщения не определялась, поскольку это вряд ли имеет физический смысл.
Расчет адиабатического кипения по программе HCh затруднен. Программа, минимизируя потенциал Гиббса, производит расчет равновесия изобарно-изотермической системы, в то время как при адиабатическом кипении температура является зависимым параметром [Bychkov, 1993].
В предшествующих работах, где моделировалось кипение, авторы использовали два пути: задавали теплосодержание (энтальпию) системы как независимый параметр, который с хорошей точностью может быть вычислен через долю газообразной воды [Drummond, Ohmoto, 1985], или определяли T-p-зависимость адиабаты и производили расчеты по этой линии [Spycher, Reed, 1989]. Физико-химическая суть этих методов примерно одинакова, но во втором случае расчет адиабаты для сложной системы, содержащей газовую и жидкую фазу, увеличивает ошибки в задании T и р для конкретных состояний. Абсолютные величины этой ошибки небольшие, и в области высоких давлений ими можно пренебречь, но когда давление меняется от 0,95 до 1,2 бар, ими пренебрегать нельзя. Поэтому был выбран первый путь. Для четырех изотерм 98, 100, 102 и 105 oС были рассчитаны равновесные состояния при разных давлениях. Результаты расчетов графически интерполировали и из них выбирали значения с одинаковым теплосодержанием, которое определяли по мольной доле водяного пара. В небольшом интервале температур расчета рассеянием тепла при фильтрации гидротерм пренебрегли.
Всего по такой методике были произведены расчеты четырех составов с разным газовым фактором (G/L = 0,1; 0,3; 1; 10) по четырем температурам.
На рис. 5.1 показано, как меняется доля водяного пара в случае независимого изменения температуры и давления для изотермы 105 oС. С уменьшением давления доля пара очень резко растет, и нескольких десятых долей атмосферы достаточно, чтобы практически вся вода перешла в газообразное состояние. Подобный изобарно-изотермический процесс требует поступления в систему большого количества тепла, в то время как в действительности кипение на Узоне определяется условием δQ = 0, что эквивалентно ΔH = const. Теплосодержание (энтальпия) гидротерм определяли по формуле, принятой в работах [Уайт, 1970; Fournier, 1989]:
| ΔH = Cp.t + ΔHф.п..Xпара, |
(5.8) |
где Cp - теплоемкость воды; t - температура (oС); ΔHф.п. - удельная теплота кипения воды; Xпара - доля водяного пара. На рис. 5.1 показаны значения давления, для которых при каждой температуре достигаются одинаковые значения теплосодержания (энтальпии) системы. Прочие параметры определяли обратной графической интерполяцией зависимостей от давления в изобарно-изотермической системе.
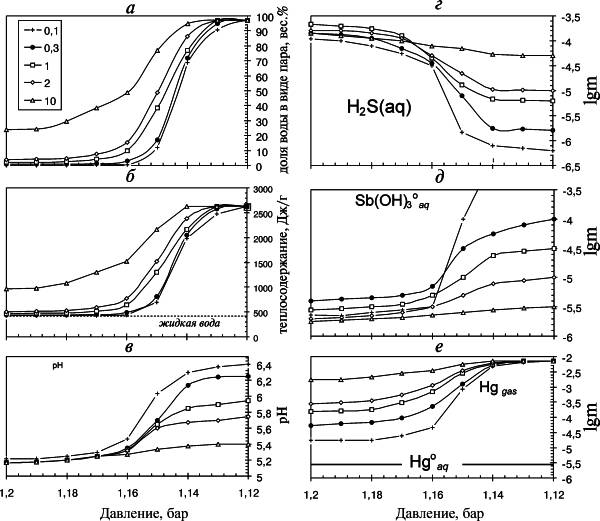 |
| Рис. 5.1. Результаты расчета кипения в изобарно-изотермической системе при температуре 105 oС и разных значениях газового фактора |
Вариант такого расчета для изобарно-изотермического кипения при температуре 105 oС приведен на рис. 5.1. Изучение особенностей поведения изобарно-изотермической системы необходимо для оценки параметров глубинных гидротерм. Результаты расчетов показали, что при уменьшении давления резко увеличивается доля газовой фазы за счет перехода воды в пар. При давлениях > 1,16 бар доля пара определяется количеством газовых компонентов (CO2, H2S). Чем больше газовый фактор, тем выше доля водяного пара в системе. В интервале давлений 1,16-1,14 бар система переходит в новое состояние: практически вся вода переходит в пар, равновесный с высококонцентрированным рассолом. Этот переход более резкий при низком газовом факторе. При этом меняются и параметры растворов: при снижении давления возрастает рН и уменьшается концентрация сульфидной серы. Такое изменение связано с тем, что водяной пар разбавляет газ, уменьшая долю кислых газов. Измеренные на Рудном Поле теплосодержание лежит в пределах 600-1500 Дж/г, значения газового фактора соответствуют 0,1-0,5. Значения рН и концентраций сульфидной серы при этих значениях близки к измеренным в скважинах.
При всех рассчитанных условиях растворимость сульфидов As оказалась > 5.10-3 моль/л, а основной формой переноса мышьяка является H3AsO3. При больших давлениях растворимость контролировалась реальгаром, при сильном выкипании становился устойчивым арсенолит. Сопоставление с концентрациями, реально измеренными на Рудном Поле, показало, что глубинный раствор не насыщен в отношении твердых фаз As.
Перенос Sb в концентрации 10-5 моль/л возможен только в гидротермах с низким газосодержанием (G/L < 1) при значениях удельного теплосодержания > 700 кДж/кг (рис. 5.1, д). Основной формой переноса Sb является комплекс Sb(OH)3o. В других условиях перенос Sb в подрудной зоне подавлен, так как растворимость антимонита ниже реально наблюдаемых максимальных концентраций.
Транспорт ртути происходит как в жидкой фазе в виде Hgo(р-р), так и в газе в виде пара. Осаждение ртути может происходить в виде жидкой самородной ртути. Перераспределение ртути между газом и жидкостью определяется константой Генри, и в газе ее переносится существенно больше. На рис. 5.1, г показана концентрация подвижных форм Hg в системе в целом. По всей видимости, глубинный флюид на Узоне не насыщен по элементарной ртути.
Расчет модели кипения выполнен до измерения на Узоне значений теплосодержаний и газового фактора в системе [Бычков, Гричук, 1991]. Результаты моделирования показали приведенные выше ограничения этих параметров для транспорта сурьмы. В дальнейшем удалось напрямую измерить их величины на Узоне. Эти замеры оказались в хорошем согласии с предсказанными, но дают более широкий интервал значений. Это связано с методическими проблемами измерения (см. гл. 4). Поэтому природные измерения не могут уточнить исходные данные для модели.
Очевидно, что процесс выкипания, описанный выше, будет наблюдаться только в изобарно-изотермической системе и потребует сообщения большого количества тепла, что видно на рис. 5.1, б, где показано теплосодержание системы, определенное через долю парообразной воды. Поэтому, для того чтобы определить ход процесса в реальной адиабатической системе при каждой температуре, были выбраны варианты расчетов, в которых достигались значения теплосодержания 500, 700, 1500 и 2000 Дж/г. Результаты для G/L = 0,3 приведены на рис. 5.2.
Расчеты показывают, что при подъеме к поверхности кипящих гидротерм изменения рН и концентрации растворенного сероводорода в адиабатических условиях весьма незначительны. Некоторое уменьшение концентрации растворенной сурьмы к поверхности связано, главным образом, с уменьшением устойчивости этого комплекса при понижении температуры. Такое плавное изменение не объясняет локального положения антимонитового горизонта в разрезах Рудного Поля, поскольку большая часть Sb будет доходить до поверхности. Замеры концентрации сурьмы показали, что в глубинных растворах эти значения ниже, чем можно было ожидать по растворимости антимонита, и только в рудном горизонте возрастают до расчетных. Вероятно, глубинные гидротермы не насыщены антимонитом.
Расчетные концентрации мышьяка и ртути к поверхности растут, и во всех вариантах расчетов концентрация As и подвижных форм Hg > 10-3 моль/кг (∑H2O). Вероятнее всего, глубинные кипящие растворы не насыщены по этим компонентам. Предельные значения растворимостей не имеют прямого отношения к процессам на Узоне и потому на рисунке не приведены.
Результаты расчета показывают, что процесс кипения не может быть главным в формировании рудоконцентрирующего геохимического барьера. Кипящие двухфазные гидротермы обладают высокими растворяющими свойствами, и в них могут переноситься As и Hg в концентрациях, превосходящих наблюдаемые на Узоне, а Sb - сопоставимыми с ними. Модель кипения описывает перенос рудных компонентов ниже зоны конденсации и на тех участках, где изотерма 98 oC подходит к поверхности и оруденение не наблюдается. Она позволяет ограничить возможное газосодержание в глубинном флюиде величинами G/L ≤ 1 и теплосодержания значениями > 700 Дж/г.
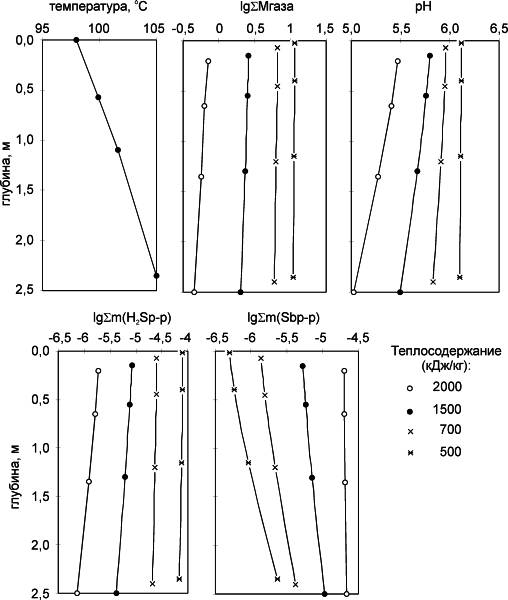 |
| Рис. 5.2. Результаты расчета кипения в адиабатической системе для газосодержания G/L = 0,3 при разном теплосодержании системы |
5.4. Модель охлаждения
Расчет модели охлаждения со смешением является традиционной задачей для термодинамического моделирования [Гричук, 2000; Методы..., 1988]. В этом случае последовательность смешения представляется в виде цепочки состояний (реакторов) с определенными температурой и давлением. Состав системы в каждом реакторе определяется пропорцией смешения горячего и холодного растворов для данной температуры. Для Узона, как это показано в гл. 4, вовсе не является обязательным уменьшение температуры, связанное с разбавлением грунтовыми водами, а охлаждение может происходить только за счет теплопроводности близповерхностных пород. Более того, однозначных свидетельств влияния пресных вод в зоне рудоотложения не обнаружено.
Однако если разбавление происходит, этот процесс может препятствовать отложению минералов. Поэтому были рассчитаны два варианта модели: разбавление холодной (10 oС) чистой водой и охлаждение без смешения. В последнем случае исходный состав системы оставался постоянным при всех температурах. По данным термосъемки был построен характерный температурный разрез для участка Рудного Поля с полной рудной зональностью, и с его помощью рассчитывали пропорцию смешения, давление вычисляли как гидростатическое. Были рассчитаны варианты модели для разных G/L в глубинном флюиде: 0,01; 0,1; 0,4; 2 и 10.
Поскольку концентрации рудных компонентов в глубинном растворе определены не вполне надежно, в систему закладывали их заведомый избыток и определялась растворимость устойчивых при этих параметрах минералов. Поскольку их концентрации очень низкие, они не влияют на другие параметры системы, то есть с геохимической точки зрения Hg, Sb, Fe и As ведут себя как микроэлементы.
Процесс рудоотложения описывается последовательным рядом состояний системы, температура и состав которых определяются пропорциями смешения горячего глубинного флюида и холодной грунтовой воды. Результаты расчетов показали, что при разбавлении флюида холодной водой уменьшается объем газовой фазы (рис. 5.3) и она относительно обогащается CO2 и H2S за счет быстрой конденсации водяного пара. Снижая рН раствора и возрастает концентрация сульфидной серы (рис. 5.3).
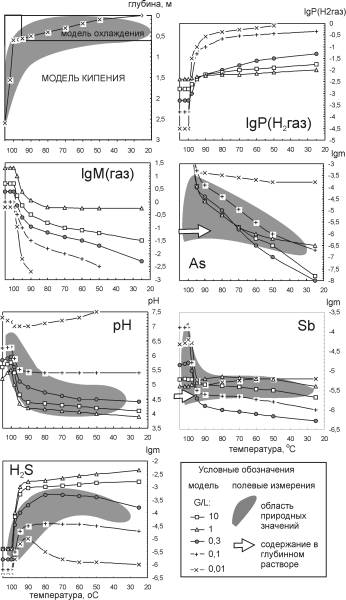 |
| Рис. 5.3. Результаты расчетов модели охлаждения с разбавлением |
Изменение рН, m(H2S) и поведение рудных компонентов сильно зависят от соотношения G/L в составе флюида. В системе с G/L = 0,3 (наиболее вероятном, как следует из модели кипения и природных измерений) при охлаждении гетерогенного флюида от 100 до 50 oC рН снижается с 6,3 до 5,2, а концентрация растворенных форм сульфидной серы возрастает с 10-6 до 3.10-4 моль/л. Концентрация Sb, равновесная с антимонитом, уменьшается в интервале 100-95 oC на 2 порядка, и выпадает 99% исходного количества Sb в виде антимонита. Концентрация As уменьшается более плавно - в интервале 100-80 oC 90% его выпадает в виде реальгара. При более низких температурах реальгар сменяется самородным мышьяком, что к поверхности в газовой фазе связано с увеличением доли труднорастворимых газов, в том числе водорода. Именно этот компонент определяет в модели окислительно-восстановительный потенциал.
В варианте с низким G/L = 0,01 система при охлаждении становится гомогенной - газы полностью растворяются в воде, что ведет к иному характеру изменения рН и lgm(H2S). Равновесные концентрации As и Sb снижаются не столь резко, как при G/L = 0,3, и часть Sb и As глубинного раствора (10 и 25% исходного количества соответственно) доходит до поверхности. При этом реальгар и антимонит отлагаются по всему разрезу. При G/L = 1-10 изменения рН и lgm(H2S) аналогичны варианту с G/L = 0,3, но выражены резче. Вследствие этого диапазон осаждения реальгара сужается до 100-80 oС, а перенос Sb в этих условиях невозможен.
Варианты расчетов охлаждения с разбавлением пресной водой и без разбавления различаются слабо. Это связано с тем, что разбавление в модели происходит не более чем в 2 раза, в то же время концентрации рудных компонентов меняются на несколько порядков. Можно утверждать, что разбавление гидротерм практически не влияет на отложение рудных компонентов, а главным фактором рудоотложения является охлаждение растворов. Предположение некоторых исследователей, что газовая фаза обгоняет жидкость и может обогащать холодные части системы сероводородом [Сорокин, 1988], представляется избыточным. Даже если этого не происходит (что алгоритмизировано в модели как постоянство газового фактора), при снижении температуры раствор достаточно обогащается H2S для отложения сульфидов. Причем для G/L > 1, как видно из рис. 5.3, г, дальнейшее увеличение газосодержаний не приводит к дополнительному насыщению растворов сероводородом.
В зависимости от газового фактора можно получить большой диапазон значений рН и концентраций сульфидной серы. Это хорошо объясняет тот факт, что при замерах этих параметров с использованием прямых методов на Узоне не обнаруживается единый тренд (см. гл. 3) зависимости от температуры. Результаты исследований, проводившихся в шурфах, где предполагался повышенный газовый поток из-за нарушения условий разгрузки, хорошо согласуются с результатами расчетов системы с высоким газовым фактором (G/L > 1). Для них характерны низкие значения рН (3,5-4,5) и высокие содержания сероводорода (до 5.10-3). Замеры в открытых шурфах, где газ мог теряться, близки к результатам расчетов с низким газовым фактором (G/L < 0,1). Значения рН при 70 oС достигают 6-6,2, а концентрации сульфидной серы низкие - 10-4-10-5.
Для ненарушенных разрезов от точки к точке газовый фактор, вероятно, меняется, что приводит к большим интервалам значений. К сожалению, на сегодня нет данных, для которых можно было бы сопоставить изменение этих параметров и газового фактора. Принципиальный вывод из модели охлаждения - все интервалы рН и концентраций сульфидной серы, прямо измеренные на Узоне, могут быть объяснены лишь изменением газового фактора в разных частях системы. Поскольку соотношение потоков газовой и жидкой фаз сильно зависит от проницаемости среды, нет ничего удивительного в том, что G/L в разных частях разреза меняется. Прямые замеры газового фактора мы выполняли только в зонах термоаномалий, так как в зоне конденсации этого сделать по этой методике нельзя, поскольку велика доля газа, растворенного в воде.
Сопоставление результатов моделирования (рис. 5.3) с условиями образования рудных минералов Узона показало, что измеренные значения рН и концентраций растворенных форм сульфидной серы совпадают с рассчитанными при величинах G/L между 0,1 и 1,0. Модельная рудная зональность согласуется с наблюдаемой в нижней части разрезов флангов термоаномалий, где узкая зона антимонита, образующегося при 100-95 oС, сменяется выше более широкой зоной реальгара - при 95-70 oС. Однако в данной модели не фиксируется образование аурипигмента, который встречается почти повсеместно в верхних частях разреза. Более того, на месте аурипигмента обнаруживается самородный мышьяк, который вообще никогда на Узоне обнаружен не был. Это не соответствует наблюдаемой минералогической зональности.
В модели охлаждения окислительно-восстановительный потенциал повсеместно в системе задается парциальным давлением водорода. Сероводород и двуокись углерода растворяются в воде, а водород, как слаборастворимый газ, обогащает газовую фазу. В составе исходного газа содержится ~0,1 об.% H2, при температуре 95 oС, а при 50 oС его концентрация доходит до 15 об.%. Таким образом, к поверхности в модели возрастает парциальное давление водорода, что противоречит прямым замерам окислительно-восстановительного потенциала. Именно это приводит к тому, что в модели охлаждения отсутствует аурипигмент. Расчетные концентрации окисленных форм серы также противоречат природным: концентрации тиосульфата, сульфита и полисульфанов всегда исчезающе малы (< 10-10 моль/кг), что обусловлено восстановительными условиями в модели. Вместе с тем количество водорода не слишком большое, при G/L = 0,1 на 1 л воды приходится ~0,4 ммоль H2. Чтобы модель наиболее отвечала природным закономерностям, необходимо добавление эквивалентного количества окислителя.
5.5. Модель окисления
Модель окисления по алгоритмизации в целом аналогична модели смешения с разбавлением, с той лишь разницей, что в качестве разбавителя выступает не чистая вода, а раствор, содержащий окислитель. В качестве окислителя принят сульфат, как предполагает Г.А. Карпов [1988]. Признание этого соединения в качестве окислителя требует "размораживания" реакций восстановления сульфата, которое может быть достигнут только в результате жизнедеятельности сульфатредуцирующих бактерий. Разумеется, в действительности этот процесс не может быть равновесным, но, моделируя достижение термодинамического равновесия, можно определить максимальную степень его протекания. Вместе с тем интенсивность процесса бактериальной сульфатредукции будет функцией температуры. В благоприятных условиях этот процесс будет протекать более глубоко, в неблагоприятных - практически заторможен. К сожалению, область максимального развития сульфатредуцирующих бактерий на Рудном Поле неизвестна, а, по данным Г.А. Заварзина и других микробиологов [Заварзин и др., 1967; Бонч-Осмоловская, Карпов, 1987; Заварзин, Карпов, 1982], практически во всем интервале температур 25-100 oС встречаются разные виды этих бактерий. Поэтому в модели не ограничено восстановление сульфата и при высоких температурах.
В качестве охлаждающего агента приняли не пресную грунтовую, а обогащенную сульфатами воду, пропитывающую поверхностный слой грунта Рудного Поля. Эта вода образуется в основном в результате окисления гидротермального раствора кислородом воздуха. Для получения ее состава был рассчитан равновесный состав смеси с G/L = 0,1 в открытой по кислороду атмосферы системе при 25 oС и в условиях равновесия всех форм серы. Состав полученного модельного раствора оказался весьма близким к реально наблюдаемым в верхних частях разрезов Рудного Поля. Все формы серы окислились до серной кислоты, что обусловило низкий рН (2,7). Затем был рассчитан ряд состояний системы, отвечающей схеме смешения, аналогичной модели смешения с охлаждением, но с новым охлаждающим агентом. Сульфат в этом варианте принимали равновесным с другими компонентами системы.
Данные расчетов (рис. 5.4) показывают, что модель окисления в целом близка к модели смешения с охлаждением (рис. 5.3). Принципиальные отличия устанавливаются в изменении рН и парциального давления Н2 с глубиной. При <размораживании> равновесия между сульфидной и сульфатной серой рН раствора уменьшается до 2,9-3, а Р(H2), резко падает на 10 порядков. При этом рН слабо зависит от газового фактора, поскольку задается серной кислотой, а не газовыми равновесиями. Концентрация Sb изменяется аналогично модели смешения с охлаждением - 99% ее исходного количества выпадает в виде антимонита в интервале 95-100 oС. Концентрация As изменяется более плавно, и 99% его количества выпадает из раствора в интервале 60-90 oС. Из-за низкого РH2 при всех температурах образуется аурипигмент, а реальгар отсутствует. Это не соответствует наблюдаемой минералогической зональности.
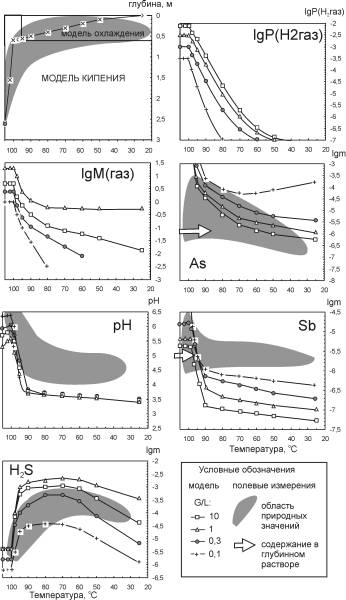 |
| Рис. 5.4. Результаты расчета модели окисления |
Сравнение концентраций Sb и As в моделях смешения (рис. 5.3) и окисления (рис. 5.4) показывает, что они принципиально не отличаются. Из этого следует, что главным фактором рудоотложения в обеих моделях являются охлаждение растворов и связанное с ним увеличение РH2S.
Процесс окисления влияет на минеральный состав руд, но не выступает как главный фактор рудоотложения на геохимическом барьере. Для отложения рудных компонентов добавление сероводорода за счет восстановления сульфата не имеет существенного значения.
Поведение ртути меняется принципиально: в модели окисления устойчива только киноварь, а растворимость ртути обусловлена комплексом H2HgS2o и весьма низкая < 10-10 моль/кг. Транспорт ртути в газовой фазе в этих условиях полностью подавлен. Поэтому практически все количество этого компонента выпадает с началом окисления в виде киновари.
Концентрации других форм серы в растворе, кроме сульфата и сероводорода, по результатам расчета низкие: тиосульфат и сульфит образуются в количестве 10-12 моль/кг, растворенная сера - 10-6 моль/кг. Элементарная сера нигде не образуется, что не совпадает с прямыми определениями на Узоне.
Главными несоответствиями модели окисления с применением сульфатредукции являются следующие факты: 1) неверное описание равновесий форм серы; 2) образование аурипигмента вместо реальгара в разрезе; 3) при изменении газового фактора рН растворов меняется слабо.
Несоответствие между моделью и наблюдениями связано с присутствием в растворе по всему разрезу значительных количеств SO42-, которые в условиях равновесной модели в паре с H2S задают Eh системы, в том числе и в наиболее горячей части рудного разреза. В глубинном растворе уже содержится ~1 ммоль сульфата, но даже этого количества достаточно для окисления всего избыточного водорода в системе, ведь требуется лишь <разморозить> равновесие между сульфидной и сульфатной серой.
Многие из противоречий модели окисления с участием сульфатредукции могут быть разрешены, если предположить, что сульфатредуцирующие бактерии имеют максимальную продуктивность при температуре ниже чем 70 oС (конкретные данные отсутствуют). При более высоких температурах применима модель охлаждения, а при t > 70 oC - изложенная выше модель окисления. В нижних частях разреза действительно будут отлагаться металлическая ртуть, антимонит и реальгар, а в верхних - аурипигмент. Из модели сульфатредукции принципиально невозможно объяснить высокие концентрации тиосульфата, сульфита и элементарной серы в растворах (см. гл. 3). Формы промежуточной валентности более доступны сульфатредуцирующим бактериям, чем сульфат, и должны быть израсходованы в первую очередь.
Сопоставление и природными данными показывает, что в разобранных вариантах моделей правильно оценены движущие факторы процесса, но не корректно описан механизм окисления верхних частей разреза.
Ни один из трех вариантов моделей не годится для объяснения полной рудной зональности: антимонит - реальгар - аурипигмент, но частные варианты наблюдаемых разрезов удовлетворительно параллелизуются с результатами моделирования. Так, безрудные разрезы на участках термоаномалий, где изотерма 98 oС (кипение при 0,95 бар) подходит к поверхности, согласуются с моделью кипения, в которой рудоотложение отсутствует. Разрезы в холодных областях, в которых развит только аурипигмент, а температуры снижаются до 50-60 oС, соответствуют модели окисления. С моделью охлаждения согласуется распределение антимонита и реальгара в нижней части разрезов флангов термоаномалий.
5.6. Полисульфанная модель рудообразования
Расчеты трех предыдущих вариантов модели показали, что предложенные в литературе концептуальные модели неудовлетворительно описывают рудообразование на Узоне прежде всего в области окислительно-восстановительных равновесий и, как следствие, в поведении компонентов, которые этими равновесиями контролируются. К ним относятся сера, мышьяк, железо и ртуть. Геохимия первых двух на Узоне изучена лучше, и именно по ним наблюдаются главные несоответствия.
Вместе с тем эта работа позволила определить, что основным фактором, контролирующим перенос рудных компонентов является кипение, а отложение - охлаждение растворов и конденсация водяного пара. Для правильного описания минералогической зональности необходимо учесть в модели механизм привноса окислителя, отвечающий природному. В настоящее время Арт.А. Мигдисовым получен большой объем данных о поведении серы в зоне рудообразования (см. гл. 3). По этим данным, единственным равновесием, отвечающим условиям потенциалопределяющей реакции (скорость установления и достаточная буферная емкость), отвечает только равновесие между коллоидной серой и сероводородом. В некоторых пробах, относящихся к реальгар-аурипигментному горизонту, истинные и коллоидные растворы элементарной серы являются преобладающей формами этого элемента. Здесь же наблюдаются и максимальные содержания элементарной серы в твердой фазе.
Происхождение максимума элементарной серы в реальгар-аурипигментном горизонте неясно. Если бы эта сера была продуктом окисления сероводорода кислородом воздуха за счет тионовых бактерий, логичнее было бы ожидать максимума выше по разрезу, в аурипигментном горизонте. Но здесь обнаруживаются лишь следовые количества серы как в растворе, так и в твердой фазе. По всей вероятности, формирование необычного реальгар-аурипигментного с узонитом и алакранитом парагенезиса и накопление элементарной серы являются следствием одного процесса.
Равновесия между мышьяксодержащими минералами можно представить как реакции с участием элементарной серы:
| 2As4S4 (реальгар) + S = As8S9 (алакранит), |
(5.9) |
| As8S9 (алакранит) + S = 2As4S5 (узонит), |
(5.10) |
| As4S5 (узонит) + S = 2As2S3 (аурипигмент), |
(5.11) |
где S записан как формальный компонент. Увеличение активности серы в этом случае приведет к смене от восстановленной ассоциации (реальгар + алакранит) к окисленной (узонит + аурипигмент). Детальное изучение парагенезисов показало, что аурипигмент отлагается по каналам и полостям, по которым двигается газовая фаза, а реальгар тяготеет к менее проницаемым породам с преимущественно жидкой фазой. Такой факт наводит на мысль о том, что элементарная сера переносится в газовой фазе. Если бы поступление этого компонента происходило вместе с более холодными поверхностными растворами, логичнее было ожидать обратного положения парагенезисов.
В работе Арт.А. Мигдисова [Migdisov et al., 1998] на основе экспериментов по растворимости элементарной серы в сероводороде показано, что сера хорошо растворяется в газе с образованием полисульфана H2S6:
| 6S(кр, ж) + H2S(г) = H2S6 (г). |
(5.12) |
При температуре 100 oС в чистом сероводороде в равновесии с кристаллической серой содержится, например, 0,5 об.% полисульфана. Как показано в гл. 4, при стандартном газовом отборе невозможно получить и сохранить этот компонент, он разлагается до сероводорода и элементарной серы. Наличие элементарной серы всегда фиксировалось в сосудах с газовыми пробами [Кошемчук, 1993]. Анализ конденсатов показал, что в высокотемпературных газах на Рудном Поле переносится 1 об.% элементарной серы в пересчете на сухой газ. С учетом того, что в газе ≤ 3 об.% H2S, эти концентрации не поддаются объяснению равновесием (5.12).
В работах Арт.А. Мигдисова показано, что в системах S-H2O крайне медленно устанавливается равновесие при подходе сверху. То есть водный раствор долгое время (часы) остается сильно пересыщенным по элементарной сере. Выпадающая затем коллоидная сера в условиях опыта практически не коагулировала. Вероятно, то же справедливо и для взаимодействия газа и раствора. Несмотря на пересыщение системы по элементарной сере, выпадение ее в осадок не происходит до тех пор, пока не достигается насыщение по коллоиду.
Только когда в ходе конденсации водяного пара парциальное давление полисульфана увеличится, пар начинает инконгруэнтно растворяться в воде:
| H2S6 (г) = H2S(р-р) + S(колл). |
(5.13) |
Возможно также, что растворение протекает через образование растворенного полисульфана
| H2S6 (г) = H2S6 (р-р). |
(5.14) |
По мнению ряда исследователей [Maronny, 1959; Migdisov, Alekhin, 1993], эта частица в растворе неустойчива и должна распадаться на сероводород и серу, однако не исключено, что некоторое время она может существовать метастабильно. Причина неустойчивости этой частицы заключается в том, что, в отличие от других полисульфанов - H2Sn (где n = 1...5), представляющих собой цепочечные соединения, газообразная частица H2S6, вероятно, представляет собой кольцо [Migdisov, Alekhin, 1993].
С другой стороны, в газовой фазе должно выполняться равновесие между полисульфаном, сероводородом и водородом:
| H2S6 (г) + 5H2 (г) = 6H2S(г). |
(5.15) |
Константа этого равновесия при температуре 100 oС равна 108. Это означает, что при наблюдаемых на Узоне мольных долях сероводорода и водорода концентрации H2S6 должны быть исчезающе малы. Для объяснения переноса элементарной серы в газовой фазе требуется признать, что равновесие (5.15) кинетически заторможено. К сожалению, данных об этом нет, но в работе [Малинин, 1969] показано, что газообразный водород не реагирует с кристаллической серой при этих температурах. Поэтому логично предположить, что и равновесие водорода с полисульфаном проходит с медленной скоростью при температурах < 100 oС и не контролирует окислительно-восстановительные условия.
Другие формы серы в растворе (тиосульфат, сульфит) образуются в результате гидролиза серы:
| 4S + 3H2O = S2O32- + 2H+ + 2H2S, |
(5.16) |
| 3S + 3H2O = H2SO3o + 2H2S. |
(5.17) |
Эти реакции формально являются реакциями диспропорционирования, но могут быть записаны и через газообразный полисульфан. Как показано Арт.А. Мигдисовым, во всех проанализированных пробах тиосульфат и сульфит имеют концентрации, близкие к равновесным с коллоидной серой [Мигдисов и др., 1991].
Выпадение серы в ходе этого процесса происходит там, где газ взаимодействует с раствором, то есть в каналах и пустотах. В этой зоне будет наблюдаться максимальная активность элементарной серы, связанная со свежевыпавшим осадком и коллоидом серы. На удалении от зон фильтрации, в менее проницаемых породах активность серы должна снижаться. В холодной зоне, где газовая фаза практически полностью отсутствует (она растворилась в ходе предшествующей конденсации), отложения серы не происходит, что объясняет низкие концентрации элементарной серы в аурипигментном горизонте.
На основании этих фактов предлагается следующая модель рудоотложения: кипящие гидротермы переносят в газовой фазе существенные концентрации элементарной серы (до 1 об.% в составе сухого газа, как показано в гл. 4). При конденсации этих гидротерм сероводород переходит в раствор, что приводит к увеличению окислительно-восстановительного потенциала и формированию других форм серы согласно реакциям (5.13) и (5.16-5.17). Предложенная концептуальная модель позволяет объяснить равновесия форм серы и окислительно-восстановительный потенциал системы за счет саморазвития гидротерм у поверхности за счет только одного фактора - охлаждения. В рамках настоящей работы недостаточно независимой информации для проверки этой модели, поскольку при построении использованы практически все результаты полевых исследований. Цель ее изучения - возможность связать в единую картину почти все известные особенности рудообразования на Узоне и получить критерии, по которым ее достижимо проверить. К сожалению, такая схема требует введения нескольких допущений о кинетических особенностях протекания реакций:
1) водород в газовой фазе неравновесен с формами серы при низких температурах. В модели это ограничение достигалось исключением этого компонента из списка газовых частиц;
2) равновесие достигается только с коллоидной серой с избыточной свободной энергией 2,8-3,1 кДж/моль. Выпадение серы как индивидуальной фазы происходит лишь при насыщении по коллоидной сере;
3) сульфат неравновесен с другими формами серы при температурах расчетов (< 105oС).
В принципе, эти ограничения не противоречат имеющейся экспериментальной информации и подтверждаются полевыми наблюдениями.
Предлагаемая модель отличается от вышеописанных лишь одним - наличием в составе глубинного газа элементарной серы в количестве 1 об.% в пересчете на сухой газ. В зоне кипения процессы описываются моделью кипения (расчет модели кипения подробно изложен в гл. 5); в зоне конденсации - моделью охлаждения без смешения с холодной водой. Теплопроводность насыщенных водой пород достаточна, чтобы обеспечить градиент температуры 100 oС/м при измеренном на Рудном Поле тепловом потоке. Результаты расчетов модели для состава с наиболее характерными параметрами для Узона: газосодержанием G/L = 0,3 и исходным теплосодержанием 1000 кДж/кг - приведены на рис. 5.5-5.6.
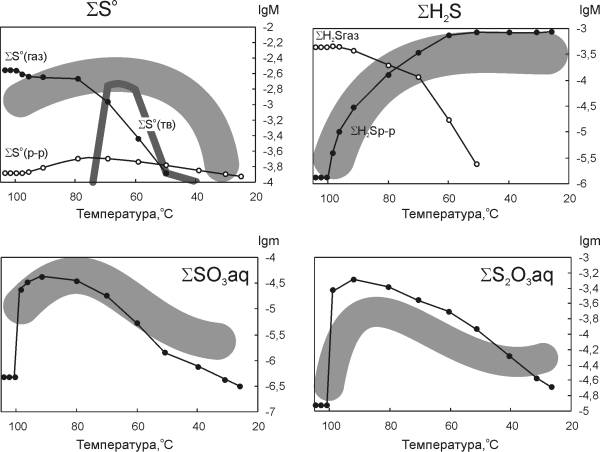 |
| Рис. 5.5. Результаты расчетов полисульфанной модели: содержание форм серы. Крапом показана область природных изменений |
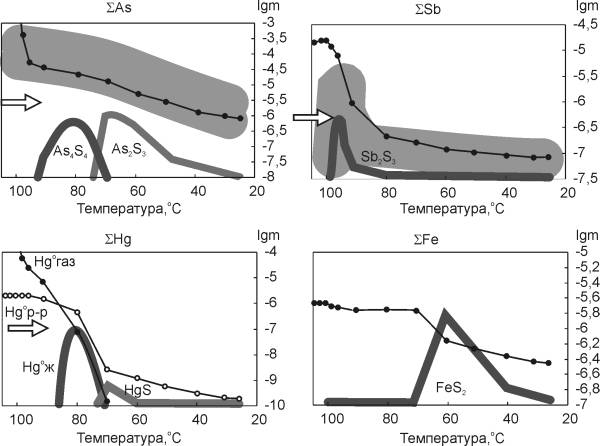 |
| Рис. 5.6. Результаты расчета полисульфанной модели: изменение содержания рудных компонентов |
Результаты расчетов модели кипения показали, что в этой части модель практически эквивалентна вышеизложенной. При высокой доле водяного пара парциальные давления сероводорода и полисульфана малы, а при температуре > 98 oС насыщения по коллоидной сере не происходит. Взаимодействие сероводорода и полисульфана в газе определяет концентрацию в растворе тиосульфата, сульфита и полисульфана:
| 4/5H2S6 газ + 3H2O = S2O32-р-р + 2H+ + 3H2Sгаз, |
(5.18) |
| 3/5H2S6 газ + 3H2O = H2SO3oр-р + 3H2Sгаз, |
(5.19) |
| H2S6 газ + 4H2Sгаз = 5H2S2 р-р. |
(5.20) |
Пока в ходе кипения парциальные давления сероводорода и полисульфана малы, среди частиц серы в растворе преобладают тиосульфат и сульфит в концентрациях 10-5 и 3.10-6 моль/кг соответственно. В ходе конденсации увеличение парциальных давлений сероводорода и полисульфана приводит к изменению концентраций тиосульфата. Для газосодержания G/L = 0,3 в начале конденсации насыщения по коллоидной сере не достигается, и из раствора осаждается реальгар. В этой части результаты практически совпадают с рассчитанными в системе, когда избыток серы не задавали (см. гл. 5). В то же время равновесия между газообразными полисульфаном и сероводородом с водным раствором формируют концентрации тиосульфата и сульфита, близкие к обнаруживаемым на Узоне при этих температурах.
Концентрации тиосульфата в расчете оказываются несколько (в 3-5 раз) выше, чем аналитически измеренные. Это можно объяснить недостаточно надежным значением свободной энергии образования этого компонента, принятым для моделирования. В то же время главная особенность поведения тиосульфата - наличие максимальных концентраций при температуре 70-90 oС - в модели воспроизводится, что связано с изменением содержания сероводорода в газовой фазе: в ходе конденсации часть H2S переходит в раствор, а это меняет соотношение парциальных давлений H2S/H2S6 в пользу полисульфана.
Основное несоответствие в описании равновесий форм серы: в расчетах концентрации элементарной серы в растворе весьма низкие, в то время как в пробах на Узоне в нижней части рудного горизонта повсеместно фиксируются значительные количества элементарной серы. Причина этого несоответствия легко объяснима: в газе, равновесном с раствором содержатся высокие концентрации элементарной серы. Поскольку при отборе газовая и жидкая фазы не разделялись, захваченный газ какое-то время еще пребывал в равновесии с раствором, постепенно охлаждаясь. При этом газовые полисульфаны могли растворяться в растворе. Кроме того, возможно образование в растворе и частицы H2S6 р-р. Однако, поскольку ее термодинамические данные неизвестны, в модели не предусмотрена возможность ее образования. Влияние образования этой частицы в растворе на равновесие форм серы, вероятно, незначительное, но может понижать парциальное давление полисульфана.
При температуре 50-60oС в расчетах раствор достигает насыщения по коллоидной сере. В то же время количество тиосульфата и сульфита в растворе снижается, поскольку увеличивается парциальное давление сероводорода. При температуре 50oС в газовой фазе остаются преимущественно труднорастворимые газы. При близких температурах в растворах Узона фиксируются максимальные концентрации элементарной серы. Вероятнее всего, они могут быть связаны с образованием коллоидной серы.
Поведение рудных компонентов в модели, учитывающей равновесие форм серы, отличается от предыдущих моделей для компонентов, которые меняют степень окисления в ходе процесса (As, Fe, Hg).
Результаты расчетов для сурьмы, поскольку ее растворимость контролируется только активностью сероводорода и рН, не изменились. По расчетам основное количество Sb выпадает в виде антимонита в самом начале конденсации, при более низких температурах транспорт этого компонента подавлен. Основные формы сурьмы в растворе: в зоне кипения преобладает гидроксокомплекс Sb(OH)3oр-р, при низких температурах существенный вклад (до 30%) вносят сульфидные комплексы - HSb2S4- и H2Sb2S4oр-р. Расчетные концентрации сурьмы в растворе в целом близки к определенным в растворах Узона.
Мышьяк переносится в глубинных растворах в форме As(OH)3oр-р. Устойчивой фазой является реальгар и его растворимость показывает, что глубинные растворы не насыщены по минералам мышьяка. Мышьяк начинает выпадать из раствора при температуре 70-80oС в виде реальгара, и в этой части результаты аналогичны модели смешения с окислением. Образование реальгара происходит согласно реакции
| 4As(OH)3oр-р + 6.4H2Sгаз = As4S4 (реальгар) + 12H2O + 0.4H2S6 газ. |
(5.21) |
в которой равновесие между полисульфаном и сероводородом задает окислительно-восстановительный потенциал.
При температуре 75 oС в расчете совместно с реальгаром начинает выпадать аурипигмент. При снижении температуры до 60 oС, когда раствор насыщается по элементарной сере, становится возможным выпадение аурипигмента совместно с коллоидной серой. Равновесное образование серы одновременно с реальгаром и аурипигментом невозможно в изобарно-изотермической системе. При температуре < 50 oС в растворе появляются, наряду с гидроксокомплексом, сульфидные комплексы мышьяка HAs2S4- и H2As2S4oр-р, но они не преобладают.
Последовательность и температуру отложения минералов мышьяка определяет его концентрация в глубинном растворе.
Железо переносится в растворе в форме иона Fe2+, и его концентрации отвечают равновесию с пиритом. На Узоне почти повсеместно фиксируется пирит, поэтому и в модели рассчитаны концентрации насыщения по этому минералу. Растворимость пирита определяется реакцией
| Fe2+ + 0.8H2S + 0.2H2S6 = FeS2 + 2H+. |
(5.22) |
Концентрации железа в растворах низкие, что согласуется с аналитическими определениями на Узоне. Однако в кипящих растворах перенос железа достаточно велик. Основное переотложение пирита связано с областью увеличения парциальных давлений сероводорода и полисульфана при температуре 90-60 oС. В модели не учитывали тонкодисперсные фазы сульфидов железа, за счет равновесия с которыми могут достигаться более высокие концентрации в растворе. Несмотря на это, результаты расчетов модели вполне согласуются с природными наблюдениями: максимальное содержание железа в твердой фазе располагается в реальгаровом и реальгар-аурипигментном горизонте.
Ртуть, как показано при анализе модели кипения, может активно переносится в газовой фазе в виде пара. Вероятно, на Узоне глубинный флюид не насыщен по элементарной ртути. При температуре 80-98 oС устойчивой фазой является жидкая ртуть. Ее отложение напрямую связано с конденсацией водяного пара и уменьшением доли газовой фазы. При дальнейшем охлаждении гидротерм начинает отлагаться киноварь:
| Hgo + 1/5H2S6 = HgS + 1/5H2S. |
(5.23) |
Как следует из этой реакции, для отложения киновари парциальное давление полисульфанов играет важнейшую роль. При появлении киновари с понижением температуры концентрация ртути в растворе быстро снижается до 10-8-10-9 и меняются формы переноса. При температуре 60 oС, когда растворы насыщены по коллоидной сере, основные растворенные в растворе формы ртути Hg2Cl2o, HgS2O3o, Hg(HS)2o, а роль элементарной формы несущественна. Общее содержание ртути в растворах становится очень низким. Реальная картина отложения ртути на геохимическом барьере зависит от содержания ртути в глубинном двухфазовом флюиде. В случае большого содержания отложение ртути начинается с образования самородной ртути. В случае если количество Hg в глубине меньше, чем 10-8 моль/кг общей (жидкой и парообразной) воды, отложение начинается при температуре 60-70 oС в форме киновари.
К сожалению, концентрации ртути в глубинном флюиде неизвестны. Все замеры, сделанные на Узоне, относятся к области конденсации и, возможно, являются заниженными по отношению к глубинным. Кроме того, практически всегда анализировали концентрации в жидкой фазе, а основные ее количества могут переноситься в газовой фазе. Результаты, полученные В.И. Сорокиным с соавт. по определению ртути в растворах из дренажных трубок (2-5.10-9 моль/кг), можно использовать для оценки общего количества ртути в двух фазах, в случае если основная форма транспорта - элементарная. Согласно модели кипения, в газовой фазе, поступающей совместно с 1 л жидкого раствора, может содержаться в 50-70 раз больше элементарной ртути (средние параметры флюида: G/L = 0,1 и теплосодержание 1000 кДж/кг для этих трубок были измерены в ходе полевых работ).
Если принять средние значения содержания ртути в глубинных растворах Узона по этим оценкам 2.10-7, то отложение начнется с образования самородной ртути, а при температуре 98-80 oС выпадет почти 95% ее исходного количества. При снижении температуры отложение будет происходить в виде киновари, и в интервале 60-80 oС выпадут оставшиеся 4,99% Hg в виде этого минерала. Максимальные концентрации ртути располагаются при температуре 90-100 oС, и горизонт обогащения этим элементом является наиболее высокотемпературным. Кроме того, реальность оценки может быть подтверждена следующим наблюдением: при хранении из проб улетучивается ртуть. Пробы из нижних горизонтов, исходно содержавшие много ртути (6-10 г/т), за год хранения потеряли 60-80% первоначального количества. Количество ртути в пробах из верхних частей разреза (3-4 ppm Hg) за время хранения не претерпели существенных изменений. Это явление можно объяснить тем, что в нижних частях разреза ртуть содержится преимущественно в элементарной форме, а в верхней - в сульфидной. К сожалению, пробы не были законсервированы после отбора, поэтому неизбежны были потери ртути до проведения химического анализа. Исследование геохимии ртути на Узоне требует специальной работы, в том числе методической, и может дать принципиальную информацию для проверки модели.
Отметим, кроме того, что в области термоаномалий, где изотерма 98 oС подходит непосредственно к поверхности и геохимический барьер конденсации вырожден, большая часть (до 99%) ртути, выносимой гидротермами, может рассеиваться в атмосфере. Существенные концентрации ртути в воздухе над термальными площадками Узона зафиксированы Н.А. Озеровой [1986].
Модель, включающая газообразные полисульфаны, весьма хорошо объясняет основные особенности рудообразования на Узоне в рамках единого процесса. Кипящие двухфазные гидротермы могут эффективно переносить рудные компоненты. Единственным фактором, образующим геохимический барьер, является охлаждение вблизи поверхности, причем преимущественно за счет теплопроводности водонасыщенных пород.
Наиболее слабым местом всех построений является предположение о существенном переносе серы в газе в зоне кипения в форме полисульфанов. На этом предположении базируется вся модель, но доказательства этого факта косвенные. Многочисленные определения газового состава на Узоне не обнаруживают полисульфаны, что можно объяснить потерей при пробоотборе и хранении. В то же время эксперименты по взаимодействию спонтанных газов с водой при разных температурах дают основание утверждать, что элементарная сера переносится в газовой фазе в условиях Узона. Возможно, специальная дополнительная работа по изучению газов даст возможность проверить модель.
5.7. Факторы формирования рудного тела на Узоне
Формирование рудного тела на Узоне представляет собой комплексный процесс. Следствия из модели позволяют определить характеристики геохимического барьера, однако только этими особенностями специфика рудного процесса на Узоне не ограничивается. Существуют некоторые дополнительные факторы, которые влияют на формирование рудного тела, но не учтены напрямую в модели:
цикличность процесса, условно называемая сезонной;
различия в разгрузке для разных термических областей Рудного Поля;
особенности кристаллизации и перекристаллизации минералов.
Термодинамическая модель не описывает напрямую эти факторы, но их воздействие выделяется по природным наблюдениям.
Цикличность процесса предполагается по следствиям: наличием нескольких горизонтов обогащения рудными компонентами и фактам, выявленных при изучении минералов. В нижних слоях рудного тела реальгар и антимонит имеют формы травления, а в верхних образуют хорошо ограненные кристаллы. Кроме того, цикличностью можно объяснить то, что максимальные концентрации рудных компонентов в растворах наблюдаются именно в нижних частях горизонтов, то есть там, где можно ожидать их растворение. Данных о распределении температур и концентрации элементов в растворах в зимний период недостаточно. Однако эта гипотеза кажется оптимальной для объяснения всех перечисленных особенностей.
С самого начала работ на Узоне исследователи отмечали, что строение поверхности Рудного Поля влияет на условия разгрузки и рудоотложения. Особенно это проявляется для термоаномалий, где кипение происходит вблизи поверхности. Специфика геохимического барьера определяется тем, насколько проницаема поверхность. Если из системы через поверхность удаляется газовая фаза, это эквивалентно снижению газового фактора в модели. При существенной потере газа рудоотложение может быть ограничено или вовсе отсутствовать. Можно выделить два типа поверхностей термоаномалий: покрытые гравием (вероятно, хорошо проницаемые для газов) и глинистыми наносами или водой (вероятно плохо проницаемые). На детальных планах полигонов показано распространение глинистых наносов и ручьев. Под ними, как правило, всегда обнаруживается полный минералогический разрез (включающий антимонит, реальгар, аурипигмент), хотя развитый лишь в верхних 10-15 см (профиль Е-Е'). В одном случае (скважина 20/-25) As-Sb - минерализация имеет мощность всего 4 см, поскольку именно на этой глубине проходит изотерма 98 oС. Уникальная ситуация связана с тем, что эта точка расположена в неглубоком теплом ручье и отражает ситуацию, когда газ через поверхность не теряется. Все же для Рудного Поля более типичны поверхности, покрытые гравием, через которые газ может легко выходить. В холодные дни они выглядят как участки парящего грунта, поскольку газопаровая смесь при охлаждении конденсируется в туман. На таких участках оруденение имеет вырожденный характер - отсутствуют минеральные зоны: как правило, антимонитовая, реже реальгаровая. В отдельных случаях встречены участки, на которых совсем не фиксируются минералы мышьяка и сурьмы (точка 20/5). Возможно, это объясняется отсутствием геохимического барьера из-за потери газов через поверхность. Действительно, 10-15 см гравия не могут быть препятствием для газопаровой смеси. В этом случае гидротермальные растворы стекают к флангам термоаномалий и осаждают там свои рудные компоненты. Такое объяснение не противоречит наблюдениям на Рудном Поле.
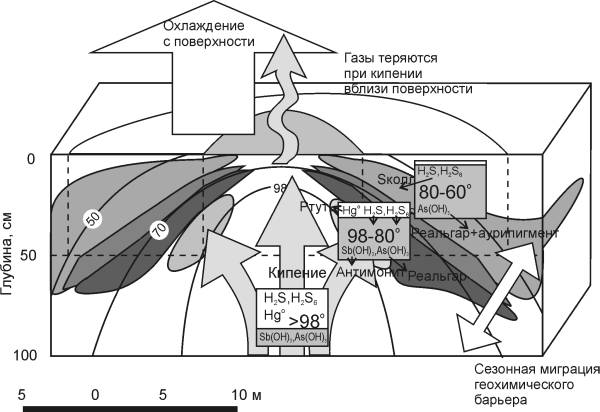 |
Рис. 5.7. Факторы, влияющие на формирование минералогической зональности на Рудном Поле
В прямоугольниках отмечено состояние системы по результатам расчета термодинамической модели при разных температурах: > 98 мС - модель кипения, ртуть, сероводород и полисульфаны переносятся преимущественно в газе; 98-80 oС - начало конденсации, сероводород растворяется в воде, выпадают антимонит и реальгар; 80-60 oС - выпадение коллоидной серы, осаждение реальгара и аурипигмента
|
В рамках равновесной модели не находит объяснения образование множества индивидуальных фаз сульфидов мышьяка и серы. Минералогические исследования показали, что специфику минералогии Узона, в том числе образование двух редких минералов - узонита (найден только на Узоне) и алакранита (описан на двух объектах), можно объяснить как сложный (и, возможно, циклический) процесс перекристаллизации минералов. Первоначально из раствора выпадают реальгар в виде кристаллов и аморфный тонкодисперсный аурипигмент или коллоидная сера. Коагуляция серы ведет к уменьшению химического потенциала So, поэтому аморфный аурипигмент перекристаллизуется не в кристаллический агрегат, а в сульфиды с меньшим содержанием серы (узонит, алакранит). Наибольшее развитие реальгар-аурипигментный горизонт имеет на флангах термоаномалий, где имеют наиболее широкое развитие узонит и алакранит. Образование этих фаз, вероятно, связано с режимом серы и циклическим (сезонным) изменением условий рудообразования.
Аурипигментный горизонт также имеет свои особенности: он наиболее широко распространен на Рудном Поле, даже в тех областях, где нет реальгара. Его положение не контролируется изотермами. Вместе с тем именно в форме аурипигмента на Рудном Поле содержится большая часть мышьяка в рудных разрезах. Образование всего аурипигментного горизонта в рамках единого процесса с другими минеральными зонами не представляется возможным: низкая растворимость реальгара приводит к тому, что почти весь мышьяк из глубинного раствора отлагается в реальгаровом и реальгар-аурипигментном горизонтах. Действительно, в аурипигментном горизонте растворы содержат мало мышьяка, что вполне согласуется с результатами моделирования. По всей видимости, аурипигмент мало растворим поверхностными кислыми растворами, дождевой водой и может сохраняться в "экзогенных" условиях. Поэтому, вероятно, аурипигментный горизонт является конечным резервуаром стока мышьяка в ходе экстремальных состояний геохимического барьера. По-видимому, в некоторые годы температура подходит к поверхности максимально близко. Реальгар растворяется термальными растворами и переотлагается выше. В течение последующих более холодных годов он переходит в глобулярный аурипигмент под действием растворов содержащих серу. Поэтому в аурипигментном горизонте возникает недостаток серы, что приводит к низкой концентрации элементарной серы и образованию аморфных натечных образований состава AsS.
Выводы
1) Анализ модели кипения позволил установить, что этот фактор не может быть причиной рудоотложения на Узоне. Модель кипения описывает транспорт рудных компонентов. В условиях Узона мышьяк и сурьма переносятся в растворе в виде гидроксокомплексов, ртуть - преимущественно в виде пара в газовой фазе. Саморазвитие глубинных флюидов при подъеме к поверхности приводит к формированию разрезов, в которых сульфиды Sb и As отсутствуют или развиты слабо.
2) Анализ модели охлаждения показал, что этот процесс может приводить к образованию двухчленного зонального разреза: антимонит - реальгар. В рамках этой модели не получает объяснения образование аурипигмента, вместо него в верхних частях разреза устойчив самородный мышьяк, причиной тому - низкий окислительно-восстановительный потенциал, связанный с накоплением в газовой фазе труднорастворимого водорода при охлаждении системы.
3) Модель охлаждения с окислением за счет сульфатредукции может объяснить образование двухчленного зонального разреза: антимонит - аурипигмент. Главными несоответствиями этой модели с природными наблюдениями являются: отсутствие реальгара, неверное описание равновесия форм серы и низкий рН растворов. Фактор окисления необходим для правильного описания минералогической зональности, но его конкретный механизм не отвечает сульфатредукции.
4) Полисульфанная модель объясняет формирование полного рудного разреза как следствие саморазвития системы в условиях охлаждения с поверхности. Расчетные концентрации растворенных форм серы и рудных компонентов находятся в хорошем согласии с природными данными.
|

