|
Следующий вопрос - выбор исходных веществ для эксперимента.
С точки зрения общих представлений безразлично, каким путем достигается
равновесие - оно не зависит от предыстории процесса. Однако скорость достижения
равновесия, возможность образования метастабильных фаз
неодинаковы при использовании различных исходных веществ. Первоначально
для исследования систем и синтеза минералов использовались смеси окислов
(реактивов, выпускаемых промышленностью), а для моделирующих экспериментов
- природные минералы и горные
породы. В последнем случае часто бывает трудно отнести результаты
экспериментов к какой-либо определенной химической системе, так как их
состав очень сложен. При этом появляется ряд неконтролируемых факторов,
влияние которых трудно понять и учесть при интерпретации результатов опытов.
С другой стороны, некоторые экспериментаторы считают, что при изучении
равновесий следует использовать природные минералы. Все несовершенства
их состава (наличие элементов-примесей, дефектов, небольшие отклонения
от стехиометрии) и структуры образовались естественно
и характерны для природного процесса. Для изучения фазовых равновесий
в определенных химических системах используются фазы - минералы, синтезированные
из реактивов в специальных опытах. Иногда (например, для полевых
шпатов и цеолитов) природные образцы очищают
путем ионного обмена щелочами между минералом и расплавом соответствующего
хлорида Na или K.
Наилучшей реакционной способности при гомогенности исходной смеси удается
достигнуть, используя в качестве исходных твердых фаз стекла или гели.
Стекло - закаленный расплав,
представляет собой метастабильное состояние вещества, что и определяет
его высокую реакционную способность. Стекло можно получить путем плавления
природных минералов, а также смесей окислов.
При изготовлении смесей для плавления хорошо
использовать следующие реактивы: Na2CO3,
MgCO3, Al2O3, SiO2, K2CO3,
CaCO3, FeO. Окислы и реактивы (или
природные минералы) смешиваются в соответствии со стехиометрией и перетираются
под слоем спирта или ацетона (огнеопасен!)
для предотвращения окисления и лучшего перемешивания. Измельчать образцы
природных минералов (перед перетиранием) нужно в специальной металлической
ступке. Перетирать вещества следует в фарфоровой или яшмовой ступке. Порошок,
приготовленный для плавления, должен иметь крупность не более 0,5 мкм.
Учитывая различную твердость исходных веществ, следует перетирать их отдельно
друг от друга, а потом тщательно смешивать. Плавить образцы силикатных
и алюмосиликатных стекол надо в платиновых, алундовых или графитовых тиглях,
в зависимости от температуры плавления стекол и атмосферы печи; так платиновые
и алундовые тигли применяются в окислительной атмосфере, а графитовые
- в инертной или в вакууме. Лучший материал для тигля - платина, она не
вступает в реакцию с силикатным расплавом до температуры примерно 1600оС.
Для более высоких температур можно рекомендовать алундовые тигли; однако
при температуре 1800оС около стенок алундового тигля образуется
некоторое количество муллита (мощность зоны загрязнения 20 - 30 мкм. Графитовый
тигель не реагирует с расплавом, но расплав загрязняется мелкодисперсным
графитом. При плавлении следует помнить о различной летучести компонентов
расплава. Особенно это важно для расплавов, содержащих большие количества
Na2O. Как
правило, это лейкократовые минералы (альбит, нефелин),
имеющие невысокие температуры плавления. Навески таких минералов желательно
помещать в запаянные платиновые ампулы. Время выдержки для переплавления
и гомогенизации расплава сильно зависит от перегрева
(превышения температуры печи над температурой плавления минералов). Так,
плагиоклазовые стекла получались высокогомогенными при температуре 1800оС,
т.е. при перегреве на 250-700о. Время выдержки при плавлении
при такой температуре не превышало 10 - 20 мин. Стекла плагиоклазов, полученные
в газовой печи при температуре 1600оС
(и выдержке 1 ч. 20 мин.), оказались гомогенными по распределению Na,
K, Ca, но распределение Si
и Al
было неравномерным - разница в концентрациях достигала 2-3 массовых процента.
В таких случаях для достижения гомогенности стекла
необходимо двукратное или трехкратное переплавление с предварительным
перетиранием стекла. Важный момент в приготовлении стекол - процесс закалки.
Лучше всего тигли с расплавом (объемом до 30 см3)
закаливать в воде - происходит почти мгновенная закалка (5-10 с). Закалку
больших тиглей проводить таким способом можно только с соблюдением некоторых
мер безопасности - стекла в больших слитках часто трескаются из-за резких
термических напряжений. Можно рекомендовать выливать расплав из тиглей
в стальную плиту (толщина плиты не менее 15 - 20 мм) - происходит достаточно
быстрое охлаждение и закалка стекла. Малые количества стекол до 5 см3
можно закаливать охлаждением тигля на воздухе. Следует помнить о различной
способности веществ образовывать стекла. Так, альбитовые и нефелиновые
(натровые составы) в сравнительно больших объемах (до 50 см3)
хорошо закаливались охлаждением на воздухе, в то время как стекла анортитового
состава закаливались плохо, образуя агрегаты кристаллов анортита. Для
достижения высокой степени гомогенности полученные стекла измельчаются
и переплавляются снова. Состав и степень гомогенности стекол должны обязательно
контролироваться. Отсутствие кристаллических фаз можно контролировать
рентгенофазовым анализом. Проверять стекла на гомогенность лучше всего
с помощью микрозонда (иммерсионным
методом трудно оценить отклонение от гомогенности меньшие, чем 3 -
5 мольные процента).
Гели. Другой метод приготовления
гомогенной и реакционноспособной исходной смеси заданного состава - гелевый.
Суть его заключается в одновременном осаждении из раствора оксидов металлов
(Mg, Al, Fe и др.) и кремниевой кислоты, на поверхности которых
могут адсорбироваться щелочи (Na, K, Ca). После высушивания и прокаливания
гель превращается в тонкодисперсный порошок, состоящий из смеси оксидов.
Основной источник кремнезема для приготовления
гелей - тетраэтиловый ортосиликат или этиловый эфир ортокремневой кислоты
(С2H5O)4Si,
который в результате гидролиза: (C2H5O)4Si
+ H2O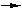 H2SiO4 + C2H5OH
переходит в кремниевую кислоту. Иногда используют стабилизированный раствор
силиката натрия или аммония высокой чистоты. Для MgO,
Al2O3 и FeO
могут быть использованы как чистые вещества, так и водные нитраты этих
элементов. Для СаО и щелочей лучшим источником служат их карбонаты
или растворы KOH и
NaOH. Карбонаты и чистые вещества переводят в
нитраты добавлением азотной кислоты. Рассчитанные растворы нитратов смешиваются
со взвешенным количеством кремнеэтилового эфира. Путем добавления нескольких
капель концентрированной азотной кислоты получают устойчивый золь,
который вследствие полимеризации кремниевой кислоты с течением времени
переходит в гелеобразное состояние. Гель высушивается на водяной бане
или в сушильном шкафу при постепенном повышении температуры (до 1050
С) в течение двух дней и затем прокаливается также при постепенно возрастающей
температуре (до 10000
С). Готовый гель - белый пылевидный порошок - из-за гигроскопичности
следует держать в эксикаторе. Соответствие состава
теоретическому достигает 0,2-0,5 % (от общего веса) для большинства отдельных
компонентов и 3,5 % для кремнезема.
H2SiO4 + C2H5OH
переходит в кремниевую кислоту. Иногда используют стабилизированный раствор
силиката натрия или аммония высокой чистоты. Для MgO,
Al2O3 и FeO
могут быть использованы как чистые вещества, так и водные нитраты этих
элементов. Для СаО и щелочей лучшим источником служат их карбонаты
или растворы KOH и
NaOH. Карбонаты и чистые вещества переводят в
нитраты добавлением азотной кислоты. Рассчитанные растворы нитратов смешиваются
со взвешенным количеством кремнеэтилового эфира. Путем добавления нескольких
капель концентрированной азотной кислоты получают устойчивый золь,
который вследствие полимеризации кремниевой кислоты с течением времени
переходит в гелеобразное состояние. Гель высушивается на водяной бане
или в сушильном шкафу при постепенном повышении температуры (до 1050
С) в течение двух дней и затем прокаливается также при постепенно возрастающей
температуре (до 10000
С). Готовый гель - белый пылевидный порошок - из-за гигроскопичности
следует держать в эксикаторе. Соответствие состава
теоретическому достигает 0,2-0,5 % (от общего веса) для большинства отдельных
компонентов и 3,5 % для кремнезема.
Иногда используют метод замораживания
- высушивания. Водный раствор органических солей нужных элементов в стехиометрических
пропорциях замораживают в жидком азоте. Затем образец сушат в вакууме
и прокаливают при температуре 10000
С, при этом образуется тонко перемешанная смесь окислов. Реакционная способность
этой смеси в 5 - 10 раз выше, чем у механической смеси или гелей, приготовленных
по стандартной методике.
Благодаря подчеркнутой в предыдущих главах каталитической роли воды
в природных процессах этот компонент присутствует в подавляющем большинстве
экспериментов. Поэтому гигроскопические вещества, а также те, которые
разлагаются и окисляются при нагреве (CaCl2, FeCl2,
MgCl2, KOH, NaOH, KF, NaF и др.), вводят в систему в виде
водных растворов.
Растворы готовят на основе дистиллированной
воды. Их концентрацию можно контролировать по плотности. При этом
надо помнить, что стекла ареометров разъедаются концентрированными щелочами.
Хранить такие растворы лучше всего в полиэтиленовых банках и бутылках
с плотно закрывающимися крышками.
 |
| Рис. 119. Устройства, используемые для
точной дозировки малых объемов ( 1 - 5000 мм3) растворов |
Рассчитанные количества воды и водных растворов вводятся
в систему в виде точно отмеренных объемов пипетками, бюретками или медицинскими
шприцами (рис. 119). Для
точного введения очень малых объемов существуют специальные дозаторы.
Контролировать введенное количество удобнее всего по весу.
Другие летучие компоненты
стараются вводить в виде соединений - оксалатов, карбонатов, фторидов,
хлоридов. Вносимые при этом в систему катионы должны учитываться при расчете
навески. Для создания смесей воды и углекислоты часто используется
щавелевая кислота Н2С2О4 x 2Н2О.
При нагревании в зависимости от активности кислорода она разлагается по
следующим реакциям:
1) Н2С2О4 x 2Н2О
+ 1/2О2 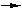 2СО2 + 3Н2О - при обычной для земной коры или
повышенной активности кислорода;
2СО2 + 3Н2О - при обычной для земной коры или
повышенной активности кислорода;
2) Н2С2О4 x 2Н2О
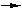 2СО2
+ 2Н2О + Н2 - при активности кислорода, соответствующей
буферу кварц-фаялит-магнетит (см. ниже раздел
"Химические условия эксперимента"); 2СО2
+ 2Н2О + Н2 - при активности кислорода, соответствующей
буферу кварц-фаялит-магнетит (см. ниже раздел
"Химические условия эксперимента");
3) Н2С2О4 x 2Н2О
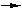 СО + СО2
+ 3Н2О - при еще более низкой активности кислорода. СО + СО2
+ 3Н2О - при еще более низкой активности кислорода.
Щавелевую кислоту необходимо перед опытом
просушивать, т.к. при комнатной температуре кристаллы Н2С2О4x
Н2О
покрываются каемкой воды. Сушить щавелевую кислоту нужно при температуре
не более 90оС (при 100оС она возгоняется). Как видно
из приведенных реакций, используя щавелевую кислоту, невозможно получить
мольную долю углекислоты во флюиде, большую, чем 0,5. Иногда вместо щавелевой
кислоты используют оксалат серебра Ag2С2О4x
2Н2О.
Он отличается меньшей гигроскопичностью. При работе с ним нужно учитывать,
что при его разложении выделяется серебро, которое может реагировать с
платиной или золотом ампулы, давая с ними сплавы.
 |
| Рис. 120. Зависимость плотности воды
от температуры и давления. |
Чистую углекислоту иногда намораживают в ампулу
по весу. Определенное количество газа можно ввести (правда, со значительной
погрешностью) в предварительно откачанный (вакуумированный) реактор или
ампулу, создавая его точно рассчитанное давление.
 |
| Рис. 121. Зависимость плотности растворов
электролитов d от концентрации (моль/л) при 4000C и 1000
бар. |
Вода и другие компоненты, формирующие во время опыта
флюид, играют в герметичных сосудах еще одну роль - создают давление
по мере повышения температуры в соответствии со своими теплофизическими
свойствами. Для автоклавов степень их заполнения
водой численно равна плотности водного флюида при температуре и давлении
опыта, которая известна до 1000оС и 8,5 кбар (рис.
120, см. также таблицы приложений).
Не лишне напомнить, что степень заполнения
берется от свободного объема автоклава, т.е. от рабочего объема
за вычетом объема, занятого твердыми веществами и (или) контейнерами,
в которые помещается навеска. Для разбавленных водных растворов электролитов
плотности несколько ниже, чем у чистой воды, при той же степени заполнения
давление будет немного меньше. Для некоторых растворов солей теплофизические
свойства изучены (рис.
121), в остальных случаях
степень заполнения берется как для чистой воды. Если опыт проводится в
герметичном контейнере (вкладыше, ампуле), помещаемом внутрь гидротермального
аппарата, внутри такого контейнера давление должно быть тем же, что и
в аппарате. Особенно важно это для контейнеров с жесткими стенками. В
тонкостенных ампулах из драгоценных металлов давление можно задавать несколько
ниже внешнего. Для углекислоты связь температуры, давления и плотности
также хорошо изучены. Смесь воды и углекислоты считают идеальной. Плотность
такой смеси в зависимости от мольной доли углекислоты
ХСО2
определяют для данных Т и Р линейной интерполяцией между чистыми водой
и углекислотой:
dсмеси
= dH2O(1-XCO2) + dCO2XCO2,
где d - плотность.
|

