|
Здесь выделяются две основные проблемы: 1) обеспечение "чистоты"
системы (или контролируемой степени "загрязнения"); 2) создание и поддержание
в течение опыта постоянства химического потенциала (активности, летучести)
одного или нескольких компонентов.
Чистота системы
- это прежде всего исходные вещества определенного заданного состава,
а также изоляция системы от внешней среды, а именно от стенок автоклавов
и сосудов высокого давления. Иногда влиянием материала сосуда можно пренебречь,
особенно при работе с малоагрессивными нейтральными растворами. Обычно
же изоляцию осуществляют с помощью герметичных контейнеров (вкладышей,
ампул) из высокоинертных в условиях опытов материалов. Лучше всего этим
требованиям отвечают драгоценные металлы: Au, Ag, Pt, Pd.
Первым применил для опытов запечатанные
платиновые ампулы П.Эскола в 1922 году.
В настоящее время из драгоценных металлов выпускаются
пробирки (ампулы) различных размеров. Чтобы использовать весь объем реактора,
его внутренность футеруется вкладышем. Когда по условием опыта допустимо
загрязнение определенным металлом, применяются контейнеры из Тi, Ni,
Cu, Fe, Mo. Для низких (до 2500C
) температур идеальным материалом, не реагирующим ни с каким растворителем,
является тефлон (фторопласт). Перспективный материал контейнеров - аморфный
углерод (стеклоуглерод). Однако стеклоуглерод хрупок и мало пластичен,
кроме того, он дорог.
Необходимо учитывать и обратное влияние системы на ампулу
(вкладыш, футеровку). Достаточно широк выбор материалов для щелочных и
нейтральных (Н2О)
сред: Pt (до 15000С),
Ag (до 6000С),
Ni (до 5000C),
сталь 45ХНФА и Сu (до 4500С).
С растворами хлоридов можно экспериментировать в Тi (до 5500С),
Рt и Au (без ограничений).
Для сульфидных систем устойчивы Тi (до 4500С),
Au (до 7000С),
Pt (4000 С).
Ниже 4000С платина
образует комплексные соединения с сульфидной серой. Титан корродируется
в сильно щелочных растворах и в растворах NH4Cl,
серебро - в кислых. Сталь "45" постепенно окисляется в кислых средах с
образованием магнетита. Наиболее устойчивы при работе с агрессивными растворами
Pt и Au.
Выше 7000С
начинает сказываться поглощение железа материалом
ампулы. Платиновые ампулы начинают поглощать железо и при 7000С.
Ампула из платины с толщиной стенок 0.1 мм выдерживает один опыт длительностью
600 часов. После этого ампула становится хрупкой и при обжатии в условиях
опыта (а иногда и при подготовке к заварке) появляются трещины в стенках.
Особенно это заметно при температурах 1100-14000С.
При таких температурах в опытах длительностью несколько часов из навески
диффундирует в ампулу до 80% валового количества железа навески. При этом
максимальное количество железа сосредоточено в тонком слое стенки с внутренней
стороны ампулы. Было предложено насыщать поверхность платиновых ампул
железом. Для этого платиновая ампула выдерживается 24 ч в расплаве Na2SiO3
- Fe3O4 (Fe3O4
- до 15 вес.% в расплаве) при температуре 12000С
и летучести кислорода, соответствующей буферу Ni
- NiO (о буферах см. во второй половине настоящего
раздела). Поглощенное железо сосредоточивается в тонком приповерхностном
слое Pt стенок, в то
время как центральная часть Pt
стенки практически не поглощает Fe,
вследствие чего ампула сохраняет пластичность. Насыщение поверхностного
слоя железом достигает 15 вес.%. Такой метод позволяет снизить потери
Fe до 10- 15% FeO
от первоначального количества. Работа по насыщению железом платиновой
ампулы требует большой аккуратности. Если железа слишком много, то ампула
становится очень хрупкой. Иногда применяют электрохимическое
напыление Fe на внутренние
стенки Pt ампулы. Такая
ампула сохраняет пластичность и инертность по отношению к Fe.
Тем не менее даже насыщенные железом Pt
ампулы при длительных опытах поглощают значительное количество FeO
из навески. Поэтому для опытов при атмосферном давлении в качестве контрмеры
используют проволочную петлю, плавление навески происходит в маленькой
петельке из тонкой Pt
проволоки. Капля расплава удерживается в петле силами поверхностного натяжения.
Таким образом, резко снижается площадь контакта Pt
c расплавом. Иногда, если позволяют условия опытов, вместо Pt
проволоки используется проволока из сплава Ag40
Pd60. При использовании тонкой
(0.1 мм) Ag-Pd проволоки
и достаточно большой навески (200 мг) потери Fe
могут быть <1% даже при длительных опытах. При плавлении по методу
проволочной петли возникает потеря Na
из расплава по реакции Na2O 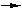 2Na
+ 1/2О2.
Потери Na прямо пропорциональны
длительности опыта и обратно пропорциональны массе навески. Потери Na2О
составляют от 20 до 50% при t =
12500 С и длительности 160 ч. 2Na
+ 1/2О2.
Потери Na прямо пропорциональны
длительности опыта и обратно пропорциональны массе навески. Потери Na2О
составляют от 20 до 50% при t =
12500 С и длительности 160 ч.
Герметизация ампул осуществляется их завариванием, запаиванием или сжиманием
сплющенных концов специальными зажимами.
Наиболее легко завариваются ампулы из Pt,
Au. Оптимальная толщина стенок ампулы 0.2 мм,
при таких стенках ампулы хорошо завариваются и выдерживают перепад давления
внутри и снаружи ампулы до 50 бар. Ag, Ni, Cu
ампулы плохо свариваются на воздухе из-за окисления. Никелевые ампулы
вообще лучше заваривать, обдувая место заварки аргоном. Серебряные и медные
ампулы завариваются плохо - примерно у 40% всех ампул сварочный шов ненадежен
и может разгерметизироваться в ходе опыта. Поэтому их надо заваривать
при аргоновом дутье или герметизировать зажимами. Для серебряных ампул
чаще применяют зажимы. Сложнее герметизировать вкладыши из Ti,
Mo, Fe, фторопласта и стеклоуглерода. Для них
уже требуются беспрокладочные затворы, способные выдержать перепад давлений
в 100-200 бар. Вкладыш как и любая герметичная ампула работает как автоклав
(конструкция "автоклав в автоклаве"). Затворами у них служат либо сварочный
шов, либо зажим. Естественно, нужно рассчитать заполнение вкладыша или
ампулы рабочим раствором. Для мягких ампул, тонкие пластичные стенки которых,
сминаясь, передают давление, внутреннее давление в них рассчитывают обычно
на 10% ниже рабочего внешнего. Лучше если ампулы несколько сожмутся, чем
их раздует, в последнем случае неизбежна их разгерметизация. Для жестких
вкладышей нежелательна деформация, поэтому давление в них рассчитывают
максимально точно равным внешнему. Если позволяет материал автоклава,
то в него заливают тот же раствор, что и во вкладыш, с таким же коэффициентом
заполнения. При таком заполнении автоклава и вкладыша исключается перепад
давлений. При снаряжении автоклава надо всегда помнить о цели, стоящей
перед исследователем: что важнее - точное значение давления в опыте или
равенство давлений внутри и снаружи ампулы. В первом случае объем ампул,
помещаемых в автоклав, должен быть примерно в 10 раз меньше внутреннего
объема автоклава, тогда изменение объема ампул не сильно изменит давление,
но зато произойдет сильная деформация (обжатие) ампулы. Во втором случае
обжатие ампул будет незначительно, но изменение давления в автоклаве будет
большим, чем в первом.
Дадим некоторые полезные советы
по изготовлению ампул.
Иногда нет в наличии Pt, Au, Ag пробирок
(ампул). Чаще можно достать листы (фольгу) драгоценных металлов (толщиной
0.5 - 1.5 мм) или Pt чашки. Из этого материала также можно изготовить
ампулы. Предварительно Рt, Au, Ag фольга обжигается (до красного
каления) и охлаждается (можно в воде). Обжиг лучше всего производить в
электрической печи сопротивления, но можно и в окислительном пламени мощной
газовой горелки. После этого фольга прокатывается через прокатные вальцы
до нужной толщины. После каждого прохода через вальцы фольга становится
все жестче ("нагартовывается"), поэтому ее периодически необходимо обжигать.
Затем изготовляется оправка для выдавливания ампулы. После этого на токарном
станке "давят" ампулу из листа фольги (оправку смазать жидким маслом).
Таким методом опытный давильщик может изготовить из фольги толщиной 0.5
мм ампулы диаметром 7мм и длиной до 50 - 60 мм. К сожалению, по современным
законам, любое изготовление изделий из драгоценных металлов требует лицензирования.
Для футеровки автоклавов
из драгоценных металлов (Аu, Ag, Pt) изготавливают специальные
вкладыши с толщиной стенок 1.5 мм. Внешний диаметр вкладыша должен быть
на 0.5 мм меньше внутреннего диаметра автоклава. Такой вкладыш предварительно
моют, сушат и отжигают. Автоклав также готовят: шлифуют внутреннюю поверхность,
тщательно моют и высушивают. После этого вкладыш вставляют в автоклав
и засыпают в него немного соли (NaCl, KCl
или NH4Cl).
Затем деревянной или медной оправкой начинают уплотнять соль, можно постукивать
по оправке молотком. Затем опять насыпают слой соли и т. д. На автоклав
с внутренним диаметром 30 мм и объемом 100 см3
надо 8-10 засыпок соли. Тогда вкладыш равномерно прижимается к стенкам
автоклава изнутри. Когда слой уплотненной соли дойдет до отбортовки, надо
легкими ударами оправки расправить конус вкладыша и плотно "приклепать"
его к отбортовке. Если вкладыш не будет плотно, без "пузырей" прижат к
автоклаву, то рабочий раствор может попасть между вкладышем и стенками.
Как правило, при этом пропадает и вкладыш, так как извлечь его без повреждений
из автоклава не удается. Так что лучше не торопиться, делать все аккуратно
и тщательно. После окончательной отбортовки вкладыша соль вымывается струей
горячей воды, автоклав сушится в печи. Дальше его можно заливать водой,
закрывать и ставить в печь на 12 часов (Т
= 500÷ 600Со,
РН2О = 1000 атм).
После такого обжатия (в опыте) автоклав можно смело эксплуатировать весьма
длительный срок (обычно 10-12 опытов длительностью примерно 700 часов).
 |
| Рис. 124. Аппарат для заварки ампул.
|
Заварка ампул.
В лаборатории, занимающейся экспериментальной петрологией, должна быть
дуговая сварка. Схема опробованного в нескольких лабораториях сварочного
аппарата приведена на рис.
124. Электродом служит
остро заточенный графитовый стержень (стержни для спектрального анализа
или извлеченные из отработанной батарейки). Другой электрод - небольшие
тиски, в которые с помощью медных зажимов крепится ампула. Во избежание
потерь летучих компонентов, введенных в систему, ампулу часто помещают
в стакан с водой или в жидкий азот. Охлаждение ампулы жидким азотом надо
проводить осторожно: температура кипения азота (-1960С)
ниже температуры кипения кислорода (-1830С),
который может скапливаться в ампуле. Для сильного охлаждения ампул лучше
использовать охлаждающие смеси, с помощью которых можно снижать температуру
до -500С. Все приспособления
для сварки можно разместить на небольшом устойчивом столике, за которым
было удобно сидеть и можно было положить локти. В процессе сварки рука,
ведущая электрод по шву, не должна быть на весу. Над тисками должен быть
экран из темного стекла и бинокулярная лупа для рассматривания качества
сварного шва. Важно тщательно подготовить верхнюю часть ампулы к заварке,
почистить мелкой шкуркой и тщательно протереть спиртом. Качество сварки
прежде всего определяется чистотой. Затем край ампулы (изнутри края ампулы
должны быть сухие и чистые !) плотно сжимаются плоскогубцами
по одной линии или по трем радиусам с помощью
патрона дрели. У плоскогубцев должна быть сточена насечка на губках. Можно
пользоваться и пинцетом (со сточенной насечкой !) или монтажными пассатижами.
Сжатые концы ампулы подравниваются ножницами или хорошо заточенными бокорезами.
Свариваемые края должны быть чистыми, плотно прилегать друг к другу и
не выступать один над другим. Подготовленная ампула закрепляется в тисках
в зажиме так, чтобы над зажимом выступали бортики шириной 2-3 мм. При
сварке рука должна вести электрод вдоль шва равномерно, но довольно быстро.
Оптимальная дуга для Рt ампул с толщиной стенок 0.2 мм получается
при напряжении 30-45В. Потеря веса при сварке составляет обычно несколько
миллиграммов. Проверку герметичности удобно проводить в воде, нагретой
до температуры, близкой к кипению (иногда применяют ванну с минеральным
маслом при Т = 150-2000C).
Небольшие дырочки сразу выявляются: из них идет струйка пузырьков воздуха.
Другой способ контроля - периодическое взвешивание после прогреваний ампулы
в сушильном шкафу при 1500 (выдержка
2-3 часа).
Другой аспект химических условий экспериментов
- создание в опыте постоянства химических потенциалов компонентов.
Для поддержания постоянной концентрации какого - либо
компонента в течение опыта предлагалось присоединение к реакционной камере
резервуара значительно большего объема, наполненного раствором
с известной концентрацией данного компонента. Однако значительные температурные
градиенты между реакционной камерой и резервуаром делают распределение
концентраций во всей этой системе слишком сложным и трудно учитываемым.
Та же идея положена в основу широко используемого "метода большой ампулы".
Суть его заключается в том, что в ампуле создается значительный (50-100
- кратный по весу) избыток жидкой фазы над твердой. Любые реакции в твердой
фазе не приводят к существенному изменению концентрации в жидкой. Система
находится в контакте с раствором, имеющим практически постоянную концентрацию
в течение всего опыта.
Приведем пример. Навеска плагиоклаза состава
An30 (50 мг) помещается
в ампулу и заливается 2.5 мл раствора NaCl
(1 M). Во всем объеме раствора содержится ~ 145 мг NaCl,
т.е. ~ 50 мг Na. В навеске
содержится 4 мг Na2О,
т.е. ~ 3 мг Na. Ясно,
что даже если плагиоклаз полностью насытится Na,
т.е. в навеске будет 4 мг Na
(если вся анортитовая составляющая изменит состав до чистого альбита),
то из раствора уйдет всего 1 мг Na.
Таким образом, содержание Na
в растворе изменится на 2%. Разницу в концентрации раствора невозможно
даже определить, используя современные химические методы
анализа раствора на Na.
При таком большом отношении навеска: раствор (1:50 - 1:100)
надо помнить о растворимости навески (даже силикатной и алюмосиликатной)
в растворе. Растворимость к тому же не всегда бывает конгруэнтной. После
извлечения ампулы из реактора и вскрытия ее исследователь рискует обнаружить
там коллоидный раствор и никаких признаков навески. Так растворимость
SiO2 в водно
- солевом флюиде при 400 С
достигает 1-3 весовых процентов.
 |
| Рис. 125. Схематические изотермические
разрезы в системе Fe - O - H при давлении воды 1 бар (по Г.Эйгстеру).
|
Теоретически безукоризненны буферные методики,
которые разработаны для поддержания определенной фугитивности
кислорода, серы, величины рН. В качестве примера рассмотрим принцип действия
буферов на фугитивность кислорода в системе Fe-O-H (рис.
125). При постоянных температуре и давлении флюид, равновесный с двумя
твердыми фазами (например, магнетитом и гематитом), имеет определенный
состав и состояние, определяющиеся соотношением в нем молекул воды, водорода
и кислорода. Другими словами, смесь гематита, магнетита и воды при заданных
температуре и давлении даст в равновесии с твердыми фазами флюид с определенными
величинами летучести указанных летучих компонентов. Между фазами будет
протекать реакция, в данном случае 4Fe3O4 + O2
= 6Fe2O3, в течение которой относительные
количества фаз будут изменяться, но летучесть кислорода
(так же, как и других составляющих флюида) будет
автоматически поддерживаться на постоянном уровне до полного исчерпания
одной из фаз. Явление совершенно аналогично остановке температуры при
фазовом переходе (например, плавлении или кипении). Таким образом, смесь
металла и его окисла или окислов разной степени окисления будет поддерживать
в изучаемой системе при данной температуре и давлении вполне определенную
летучесть кислорода. Летучесть кислорода задаваемая различными буферами,
показана на рис. 126. В водной
среде в силу равновесия диссоциации воды: Н2О
= Н2 + 1/2 О2 - летучесть
водорода и воды также будут иметь строго фиксированные значения. Проводя
опыты с различными буферными смесями, становится
возможным количественное изучение окислительно - восстановительных
минеральных равновесий. Даже при изучении простых реакций
гидратации - дегидратации проведение опытов в присутствии буфера очень
важно для поддержания на определенном уровне степени окисления компонентов,
а также для задания летучести воды, независимой от общего давления.
 |
| Рис. 126. Летучесть кислорода (бары)
для наиболее распространенных буферных смесей. |
При высоких температурах через платину, палладий и его
сплавы происходит диффузия водорода. Используя это обстоятельство, изучаемую
систему отделяют от буфера, помещая ее в герметичную ампулу, сделанную
из платины или сплава палладия и серебром. По обе стороны стенки такой
ампулы создается осмотическое равновесие - выравниваются фугитивности
водорода. Последнее смещает равновесие диссоциации воды внутри ампулы
с изучаемой системой, вследствие чего осмотическое равновесие достигается
и в отношении летучестей кислорода и воды.
 |
| Рис. 127. Двойные (совмещенные) ампулы
для опытов с буферами. |
Реально опыты проводят в двух герметичных ампулах, вложенных
одна в другую (метод "двойных ампул",
рис. 127). Внешняя делается из
золота или серебра, почти не пропускающих водород. В нее помещается буферная
смесь с некоторым количеством воды. Внутренняя, содержащая рабочую навеску,
также герметичная, изготовляется из платины или сплава платины и палладия.
Стенки реактора (обычно
сделанные из сплавов на основе никеля) создают фугитивность водорода,
близкую к той, что дает буфер Ni-NiO.
Поскольку диффузия водорода через золото все же медленно происходит (особенно
выше 8000 ), одна
из фаз сильно восстановительных (железо-магнетит, железо-вюстит, вюстит-магнетит)
или сильно окислительных (гематит-магнетит) буферов расходуется: окисляется
или восстанавливается, что приводит к уменьшению срока работы буфера.
Может также образоваться так много воды, что в ампуле возрастает давление,
и она разгерметизируется. Железо - вюститовый буфер служит всего несколько
часов при температурах 600-7000С,
магнетит-гематитовый буфер - 2-3 дня при 7500C.
Наиболее долго работает никель-бунзенитовый буфер.
Хотя кварц-фаялит-магнетитовый буфер дает летучесть
кислорода, близкую к Ni - NiO,
его время работы ограничено 4-15 днями из-за малой емкости - малого количества
выделяемого кислорода на единицу объема. После опыта необходим визуальный
контроль за сохранностью воды в буферной смеси, оптический или рентгеновский
- за сохранностью твердых фаз буфера. Для буфера с малой емкостью иногда
приходится периодически закалять опыт и восстанавливать буферную смесь.
Нижняя температурная граница "работы" кислородных буферов определяется
кинетикой установления буферного равновесия. Так, например, магнетит -
гематитовый буфер может поддерживать кислородное равновесие только при
t = 6000 C, ниже
6000С скорость установления равновесия очень мала, при 5000С
буферное равновесие не наступает даже за 200-240 ч, а более восстановительные
буферы могут работать до 5000С (например, Ni-NiO). Температура
ниже 4000С вообще делает невозможной работу кислородного буферов,
так как водород практически не диффундирует через платину при таких низких
температурах. Препятствие к применению буферов с окислами Mn -
"отравление" марганцем поверхности металлов ампул, что затрудняет диффузию
водорода.
При низких (< 5000С) температурах применяют иногда "буферы"
из органических веществ, перекиси водорода, газообразного водорода. Фактически
эти вещества не буферы, так как они расходуются в реакции (а буферной
реакции не существует), так что их концентрация в ходе опыта снижается.
Перекись водорода в зависимости от рН раствора разлагается либо с выделением
водорода, либо кислорода. Поскольку подобные "буферы" практически не могут
быть рассчитаны (трудно определить, какое количество вещества прореагировало
или сколько водорода израсходовано), они применяются только для качественного
изменения fО2.
При высоких температурах платина - лучший металл для диффузии
водорода, при температурах ниже 10000С
более быстро осмотическое равновесие достигается через палладий и его
сплавы с серебром. Выше 10000С
возникают трудности в выборе материала внешней ампулы. Серебро плавится
при 9620С, а золото
- при 10640С.
Разработаны буферы поддерживающие летучесть (активность)
многих других компонентов. Графит в равновесии с СО2+СО
может использоваться для поддержания определенных значений fО2
и fСО2,
смесь пирита и пирротина или Аg с Ag2S - для
fS2. Разработаны также буферы для
поддержания на определенном уровне рН среды.
Рассматриваемые системы моделируют петрологически важный
тип систем с вполне подвижными компонентами.
В таких системах для вполне подвижных компонентов, в отличие от инертных,
фактором равновесия вместо массы становится интенсивный
параметр (активность или летучесть) которая задается извне и не изменяется,
независимо от выделения или поглощения этого компонента при реакциях,
происходяших в системе.
Принципиальных ограничений на тип буферируемого
компонента нет. Однако, для всех компонентов, кроме водорода, не существует
и вряд ли удастся разработать перегородки, избирательно проницаемые только
для данного компонента. Поэтому буфер приходится либо смешивать с веществом
изучаемой системы, либо внутренняя ампула сжимается, но не заваривается
(см. рис. 127б),
предотвращая механическое смешивание твердых фаз, но оставаясь открытой
для флюида.
Смеси твердых фаз, применяемые в качестве буферов, можно использовать
как индикаторы (свидетели) химических условий опытов. В индикаторных опытах
фиксируется те нерегулируемые химические условия (fО2,
fS2 и др.), которые устанавливаются
в условиях равновесия в изучаемой системе. Особенно удобно в качестве
индикаторов использовать изученные равновесия с минералами переменного
состава (пирротина для измерения фугитивности серы, железотитановых окислов
- для кислорода), фиксирующих непрерывно изменение параметров в некотором
интервале.
|

