|
Чрезвычайно перспективны, хотя мало разработаны и имеют
до сих пор ограниченное применение, методы контроля фазовых
превращений непосредственно в процессе опытов.
Изменение концентрации растворов
контролируют отбором вещества через пробоотборник.
Традиционный метод пробоотбора через специальный вентиль имеет
существенные недостатки. Отбираемый раствор проходит весь диапазон условий
от параметров опыта до комнатных. На этом пути возможны неконтролируемые
закалочные явления. Кроме того, в момент отбора
нарушается равновесие в реакторе.
 |
| Рис. 129. Устройство для пробоотбора
при изотермических и изобарических условиях (конструкция В.И.Сорокина
и Н.В.Капустина). |
В устройстве, представленном на рис.
129 отбор проб флюида во время опыта проводится путем медленного открытия
пробоотборника 5. Падение давления компенсируется возрастанием давления
в прессе (вентили, ведущие к нему открываются).
Из всех возможных способов отбора
проб жидкого (надкритического) раствора предпочтителен метод отсечения
части рабочего объема непосредственно во время опыта, позволяющий избежать
нарушения равновесия между исследуемыми фазами, т.к. отсечение проводится
строго в изотермических
и изобарических условиях опыта. В пробоотборниках
такого типа раствор отбирается в пластичные ампулы - контейнеры. Их герметизация
производится зажимами, перемещающимися при движении штока с клиновидными
вырезами. Шток пропущен через сальник с фторопластовой набивкой, расположенный
в холодной зоне удлиненного обтюратора. Стенки ампулы
сжимаются с необходимым для герметизации усилием и удерживаются в таком
состоянии до конца опыта. Подобные устройства позволяют делать пробоотбор
неоднократно и исследовать, например, кинетику растворимости твердой фазы
в одном опыте. Есть также возможность отбора проб на разной высоте внутреннего
объема сосуда высокого давления и изучать таким образом гравитационную
неоднородность (расслоение) жидких фаз.
Некоторые вещества при фазовых
переходах создают акустические эффекты
(треск), что используется для градуировки твердофазных установок.Тепловые
эффекты при фазовых превращениях можно фиксировать, вводя непосредственно
в рабочий объем дифференциальную термопару
(метод ДТА). Один из ее спаев
помещается в исследуемую систему, а второй - в эталон, находящийся в непосредственной
близости. Требование к эталонам - отсутствие фазовых превращений в рабочей
области температур.
Точная фиксация фазового превращения возможна и при измерении
электропроводности (кондуктометрия)
вещества непосредственно в опыте. Сложность использования методов ДТА
и кондуктометрии заключается в трудностях ввода и изоляции проводов непосредственно
в рабочем объеме.
Огромное возрастание информации о процессах, происходящих
при высоких температурах и давлениях, стало бы возможным, если бы мы могли
непосредственно или с помощью электромагнитного излучения
различных частот (видимого, инфракрасного, рентгеновского) наблюдать
процессы, происходящие в рабочем объеме. Некоторые успехи в этой области
связаны с применением сапфировых окон в реакторах и проведением опытов
на алмазных наковальнях.
Для изучения процессов выращивания кристаллов из водных
растворов с успехом применяется голография.
Голография позволяет получить прекрасные картины диффузионных и конвекционных
явлений при росте кристаллов. Подобные эксперименты с успехом проводились
даже в космосе для исследования роста кристаллов в невесомости.
Возможность непосредственных измерений
величин летучести кислорода, соответствующих какому-либо минеральному
равновесию при заданной температуре, дают электрохимические ячейки
с твердыми электролитами.
Твердый электролит - это материал, обладающий
в широком интервале температуры ионной проводимостью, сравнимой с жидкими
электролитами. Проводимость обусловлена тем, что в структуре твердых электролитов
катионы (или анионы) обладают значительной подвижностью, т.е. не привязаны
строго к определенным узлам кристаллической решетки. Они занимают промежуточное
положение между кристаллом с регулярной структурой и жидким электролитом,
в котором отсутствует дальний порядок в расположении
катионов и анионов. Можно сказать, что твердый электролит - это ионная
жидкость в кристалле. Этому представлению достаточно полно соответствуют
такие часто используемые электролиты как  -AgI,
AgIBr, обладающие проводимостью иона Ag+; ZrO2,
стабилизированный СаО или Y2O3, который
характеризуется кислород-ионной проводимостью; CaF2,
обладающий проводимостью ионов фтора и др. -AgI,
AgIBr, обладающие проводимостью иона Ag+; ZrO2,
стабилизированный СаО или Y2O3, который
характеризуется кислород-ионной проводимостью; CaF2,
обладающий проводимостью ионов фтора и др.
 |
| Рис. 130. Принципиальная схема работы
ячейки с твердым электролитом. |
Устройство и принцип действия рассмотрим на примере кислородной
концентрационной ячейки с твердым электролитом
(рис. 130). Ячейка
состоит из двух систем - стандарта и образца, которые разделены керамикой
с кислород-ионной проводимостью (YSZ - иттрий стабилизированный диоксид
циркония или CSZ - кальций стабилизированный диоксид циркония). В каждую
из систем подведен инертный электрод - платиновая проволока. За счет разницы
давлений кислорода в системах стандарта и образца возникает ток ионов
кислорода через твердый электролит из системы с большим давлением кислорода
в систему с меньшим. Этот процесс происходит за счет возможности свободного
приема и отдачи электронов на инертных электродах согласно реакции: O2
+ 4e- = 2O2-. В свою очередь, ток ионов кислорода
в твердом электролите прямо связан с ЭДС, возникающей на электродах, которая
измеряется вольтметром. Разность потенциалов определяется энергией Гиббса
(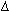 G) протекающей
реакции: G) протекающей
реакции: 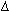 G = -nFE
= -RTlnK , где n - число единичных зарядов, переносимых в результате этого
процесса, в данном случае n=4; F - постоянная Фарадея; E - ЭДС ячейки
в миливольтах; К - константа реакции; R - универсальная газовая постоянная;
Т - температура, оК. Константа суммарного электрохимического
процесса для кислородзависимых реакций в системах стандарта и образца
в ячейке с твердым электролитом с кислород-ионной проводимостью может
быть записана как: K = f(O2)(стандарт)/ f(O2)(образец).
Отсюда легко получить уравнение, позволяющее определять летучесть кислорода
для равновесий кислород-зависимых реакций: lnf(O2)(стандарт)
- ln f(O2)(образец) = nF/RТ. Обычно
измерения проводят относительно какого-либо стандарта: например, хорошо
изученной твердофазной системы, являющейся буфером по кислороду. G = -nFE
= -RTlnK , где n - число единичных зарядов, переносимых в результате этого
процесса, в данном случае n=4; F - постоянная Фарадея; E - ЭДС ячейки
в миливольтах; К - константа реакции; R - универсальная газовая постоянная;
Т - температура, оК. Константа суммарного электрохимического
процесса для кислородзависимых реакций в системах стандарта и образца
в ячейке с твердым электролитом с кислород-ионной проводимостью может
быть записана как: K = f(O2)(стандарт)/ f(O2)(образец).
Отсюда легко получить уравнение, позволяющее определять летучесть кислорода
для равновесий кислород-зависимых реакций: lnf(O2)(стандарт)
- ln f(O2)(образец) = nF/RТ. Обычно
измерения проводят относительно какого-либо стандарта: например, хорошо
изученной твердофазной системы, являющейся буфером по кислороду.
Метод позволяет определять непосредственно и непрерывно
в течение опыта летучесть кислорода в смеси газов. Особенно ценно, что
определяется термодинамическая величина летучести (фугитивности)
кислорода, а не парциальное давление и не концентрация. Поскольку процессы
в твердом электролите полностью обратимы, можно использовать его в качестве
задатчика летучести кислорода, подавая напряжение на стенки.
|

