5.2. Метод изотопно-химической системы
Б.Н.Рыженко предложил
альтернативный подход к расчету изотопных равновесий в химически реагирующих
системах. Суть его заключается в том, что и химические реакции, и изотопный
обмен подчиняются общему принципу химической термодинамики - стремлению к уменьшению
свободной энергии системы. Если в качестве независимых компонентов системы
взять не элементы, а их изотопы, то расчет термодинамического равновесия может
проводиться для химических реакций и реакций изотопного обмена совместно.
На основе этого подхода в работах
[Банникова и др., 1984, 1987; Гричук, 1987, 1988] нами был разработан метод
термодинамического расчета изотопно-химических систем - "метод изотопно-химической системы". В отличие от двухэтапного
расчета в методе Омото (сначала - химическое равновесие, затем - изотопное)
метод изотопно-химической системы достигает результата в едином расчете. Для
расчета такого равновесия могут быть использованы стандартные программы,
разработанные для решения "неизотопных" термодинамических задач.
Следует отметить, что метод
изотопно-химической системы является теоретически более строгим, чем метод
Омото. Использование двухэтапного раздельного расчета возможно лишь благодаря
тому, что влияние перераспределения изотопов на равновесия химических реакций
относительно невелико. Сравнительный анализ преимуществ и недостатков метода
Омото и метода изотопно-химической системы приведен ниже.
Реализация метода
изотопно-химической системы требует задания термодинамических характеристик
компонентов системы - свободных энергий
Гиббса изотопных форм соединений -  fGoи.
Современные фундаментальные справочники термодинамических свойств веществ
[Термические константы..., 1965-1979; Термодинамические свойства..., 1978-1982;
ИВТАНТЕРМО, 1983-1985] содержат систематические данные только для соединений
изотопов водорода 1Н, 2D и 3Т. Для других
элементов приведены практические
термодинамические функции соединений, состоящих из природных смесей
изотопов. Они не учитывают ядерные составляющие, в том числе обусловленные
смешением изотопных форм. Для реализации метода изотопно-химической системы
необходимо иметь способ расчета свободных энергий образования изотопных форм
соединений по имеющимся экспериментальным данным. fGoи.
Современные фундаментальные справочники термодинамических свойств веществ
[Термические константы..., 1965-1979; Термодинамические свойства..., 1978-1982;
ИВТАНТЕРМО, 1983-1985] содержат систематические данные только для соединений
изотопов водорода 1Н, 2D и 3Т. Для других
элементов приведены практические
термодинамические функции соединений, состоящих из природных смесей
изотопов. Они не учитывают ядерные составляющие, в том числе обусловленные
смешением изотопных форм. Для реализации метода изотопно-химической системы
необходимо иметь способ расчета свободных энергий образования изотопных форм
соединений по имеющимся экспериментальным данным.
Эта задача была решена в работе
[Гричук, 1987], в которой было выведено общее уравнение для расчета  fGoи
по известной практической функции - свободной энергии образования соединения fGoи
по известной практической функции - свободной энергии образования соединения  fGoэ
и коэффициентам фракционирования изотопов между данным соединением и элементами
в стандартном состоянии fGoэ
и коэффициентам фракционирования изотопов между данным соединением и элементами
в стандартном состоянии  . Для произвольного соединения Z, состоящего из y химических элементов, при условии
независимости изотопного обмена между элементами в молекуле Z свободные энергии
полнозамещенных по отношению к y
форм: . Для произвольного соединения Z, состоящего из y химических элементов, при условии
независимости изотопного обмена между элементами в молекуле Z свободные энергии
полнозамещенных по отношению к y
форм:
 (5.3) (5.3)
где ny - число атомов элемента y в молекуле Z, ly - число изотопов у
элемента y, Nyjct- средние
распространенности изотопов в природе,  Z и Z и
 - поправки на возможные вариации изотопного состава
веществ. - поправки на возможные вариации изотопного состава
веществ.
Для практически важного случая
расчета задач с двумя изотопами интересующего элемента (1H-2D,
12C-13C, 14N-15N, 16O-18O,
32S-34S) уравнение (5.3) может быть существенно упрощено.
Для элемента Х, входящего в соединение AX и имеющего
Xo- легкий изотоп и X*- тяжелый изотоп:
 (5.4а) (5.4а)
 (5.4б) (5.4б)
где NXo, NX*- средние
относительные распространенности изотопов,
 - коэффициент
распределения изотопов соединения АХ относительно стандартного состояния Х. - коэффициент
распределения изотопов соединения АХ относительно стандартного состояния Х.
Выведенные уравнения справедливы
как для свободных энергий Гиббса изотопных форм соединений  fGои
, так и для приведенных свободных энергий gTои . fGои
, так и для приведенных свободных энергий gTои .
В настоящее время изотопный обмен
между геологически важными соединениями систематически изучен для небольшого
числа элементов (Н, С, О, S). Данные по изотопному фракционированию большинства
петрогенных элементов крайне немногочисленны. Поэтому в практике геохимических
исследований наиболее типичными будут задачи, в которых только для одного или
нескольких элементов из числа присутствующих в системе рассматривается
изотопное фракционирование. Такие задачи можно условно назвать
"полуизотопными", чтобы отличать их от "полноизотопных" систем, в которых
учитываются изотопы всех входящих в них химических элементов. Расчет
термодинамических свойств изотопных форм соединений для таких "полуизотопных"
систем не представляет принципиальных трудностей, так как изотопный обмен
разных элементов (кроме водорода) протекает практически независимо.
Перекрестное влияние изотопного обмена водорода на другие элементы - эффект
второго порядка значимости, его величина сопоставима с погрешностью
экспериментальных и расчетных определений  . Для расчета таких типов
задач могут быть использованы уравнения (5.4а, б) (см., например, [Банникова и др., 1987]).
Результаты термодинамического моделирования в "полуизотопной" по сере задаче
для конвективной гидротермальной системы в океанической коре рассматриваются в
разделе 5.4. . Для расчета таких типов
задач могут быть использованы уравнения (5.4а, б) (см., например, [Банникова и др., 1987]).
Результаты термодинамического моделирования в "полуизотопной" по сере задаче
для конвективной гидротермальной системы в океанической коре рассматриваются в
разделе 5.4.
Сопоставление метода Омото и метода изотопно-химической системы.
Метод изотопно-химической системы рассматривает изотопы элементов как
независимые компоненты системы. Поэтому к ним применяются общие законы
химической термодинамики, а, соответственно, - и стандартное программное
обеспечение моделирования. Метод Омото, как уже отмечалось ранее, - двухэтапный:
на первом этапе рассчитывается химическое равновесие в системе, на втором -
изотопное. Для реализации первого этапа можно использовать обычное программное
обеспечение моделирования, а для второго требуется разработка
специализированных программных блоков (см., например, [Bowers, Taylor, 1985;
Janecky, Shanks, 1989]). Каждый из методов обладает своими достоинствами и
недостатками.
Метод изотопно-химической системы. Для расчета изотопно-химических моделей гомогенных систем (жидких
или газовых) с помощью этого метода применимы любые программы
термодинамического моделирования. Однако геохимически интересные задачи, как
правило, связаны с изотопным обменом в гетерогенных системах (газ - твердые
фазы, водный раствор - твердые фазы). В этом случае каждая твердая фаза,
участвующая в изотопном обмене, должна быть представлена как твердый раствор
изотопных форм (изотопных миналов). Для моделирования таких систем требуются
программы, способные рассчитывать равновесия в системах с несколькими фазами
переменного состава. Подобные программы относятся к наивысшему классу сложности
по систематике Ю.В.Шварова [Методы геохимического моделирования..., 1988], и
число их невелико (GIBBS, СЕЛЕКТОР, HCh). Это накладывает технические
ограничения на использование метода изотопно-химической системы.
В качестве входной информации в
методе используются изотопные отношения в исходной системе и термодинамические
свойства изотопных форм соединений. Исходные изотопные отношения определяются
геологическими моделями, и качество их здесь не обсуждается. Термодинамические
свойства изотопных форм могут быть вычислены из обычных ("элементных")
термодинамических данных и коэффициентов распределения изотопов по уравнениям,
полученным в предыдущем разделе. При использовании банков термодинамических данных
типа банка UNITHRM это не вызывает принципиальных осложнений, поскольку
сводится к изменению  rGo (298oK) и двух или трех коэффициентов уравнения
теплоемкости (в зависимости от вида температурной функции для
ln rGo (298oK) и двух или трех коэффициентов уравнения
теплоемкости (в зависимости от вида температурной функции для
ln ).
Недостатком метода в этом случае может быть то, что при расчете изотопных
обменов по изотопам нескольких элементов (например, H, O и C) число изотопных
форм, которые надо учесть, резко возрастает. Это, соответственно, будет
загромождать банки термодинамических данных. В указанном отношении возможности
метода изотопно-химической системы для современного состояния
термодинамического моделирования геологических процессов представляются
несколько избыточными. ).
Недостатком метода в этом случае может быть то, что при расчете изотопных
обменов по изотопам нескольких элементов (например, H, O и C) число изотопных
форм, которые надо учесть, резко возрастает. Это, соответственно, будет
загромождать банки термодинамических данных. В указанном отношении возможности
метода изотопно-химической системы для современного состояния
термодинамического моделирования геологических процессов представляются
несколько избыточными.
Точность расчетов с помощью этого
метода определяется погрешностью исходной термодинамической информации и
точностью работы вычислительной программы. Погрешности термодинамической
информации складываются из: а) погрешностей "элементных" термодинамических
данных; б) точности коэффициентов распределения изотопов (полученных
экспериментально или расчетно), которая имеет в большинстве случаев величину от
n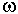 10-4
до 1-2 10-4
до 1-2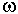 10-3
в ln 10-3
в ln .
Необходимо заметить, что допущения, использованные при выводе уравнений
(5.3-5.4), не влияют на качество расчета изотопных распределений.
Вычислительная погрешность при расчете равновесий в программах GIBBS, HCh и
GBFLOW составляет не более 10-5 от мольной доли компонента, что
эквивалентно 0,01 o/oo в определении равновесного
изотопного состава соединений. .
Необходимо заметить, что допущения, использованные при выводе уравнений
(5.3-5.4), не влияют на качество расчета изотопных распределений.
Вычислительная погрешность при расчете равновесий в программах GIBBS, HCh и
GBFLOW составляет не более 10-5 от мольной доли компонента, что
эквивалентно 0,01 o/oo в определении равновесного
изотопного состава соединений.
Из сравнения видно, что главный
источник погрешностей в разбираемом методе - это "обычные" термодинамические
данные. Внутренние источники погрешностей метода меньше их на несколько
порядков. Точно так же погрешности расчета меньше экспериментальных ошибок определения
ln . .
Метод Омото требует разработки специализированных "изотопных"
вычислительных блоков (подпрограмм), дополняющих любые программы,
рассчитывающие химические равновесия. В отношении программной реализации эти
блоки не представляют особых трудностей. В методе Омото исходные изотопные
данные не связаны с термодинамическими свойствами веществ, и их можно не
вводить в общие термодинамические банки данных. Это упрощает пользование
методом при решении частных геохимических задач. В методе Омото используются те
же gTo (или константы равновесия) и
ln , что
и в методе изотопно-химической системы. Соответственно, погрешности их
определения входят в результаты расчетов по обоим методам одинаково. , что
и в методе изотопно-химической системы. Соответственно, погрешности их
определения входят в результаты расчетов по обоим методам одинаково.
В теоретическом отношении метод
Омото менее строгий, чем метод изотопно-химической системы, поскольку в нем
использован ряд упрощений:
1) Вследствие двухэтапного
расчета в методе Омото неявно предполагается, что изотопный обмен не влияет на
равновесия химических реакций, то есть что перекрестный
изотопно-химический эффект отсутствует. Это в целом не противоречит
эмпирическим данным.
2) В используемой системе
уравнений (5.1-5.2) уравнения сохранения вещества по каждому изотопу (строго
выполняющиеся в методе изотопно-химической системы) заменены на уравнение
баланса изотопного сдвига (5.1).
3) В методе Омото при выводе
уравнений (5.2) использовано разложение функции натурального логарифма ln(1 +  )
= )
=  . .
Анализ погрешностей, возникающих
в результате этих упрощений, показывает, что они в большинстве случаев
незначительны. Упрощение (1) - игнорирование перекрестного изотопно-химического
эффекта вносит в константы уравнений химических реакций погрешность на каждый
изотопно обменивающийся атом, описываемую уравнением (5.5) [Гричук, 1998]:
 ,(5.5) ,(5.5)
где Xo- доля менее
распространенного изотопа, X*- доля более
распространенного изотопа. Для геохимически важных реакций этот эффект не
превышает n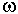 10 Дж/г-ат., и, как правило, имеет
существенно меньшую величину. Он значительно меньше обычных ошибок "элементных"
термодинамических величин. 10 Дж/г-ат., и, как правило, имеет
существенно меньшую величину. Он значительно меньше обычных ошибок "элементных"
термодинамических величин.
Упрощение (2) вносит в результаты
расчета распределения изотопов систематическую погрешность, максимальный размер
которой определяется уравнением (5.6). Для обмена между двумя соединениями:
 (o/oo).(5.6) (o/oo).(5.6)
Величина этого систематического
сдвига не превышает 0,0no/ooдля всех
легких элементов (кроме Li и B), и ее можно игнорировать в геохимических
приложениях.
Упрощение (3) приводит к
погрешности в вычислении изотопного состава, определяемой уравнением:
 ,(5.7) ,(5.7)
где  ср=( ср=( i- i- j)/2. При j)/2. При
 ср далеких от
изотопного стандарта это упрощение может привести к значительным ошибкам в
результатах, превышающим доверительные интервалы эмпирических величин,
используемых в моделях (до 3-9o/oo). Поэтому в методе Омото желательно
использовать вместо выражения (5.2) точное уравнение изотопного обмена в форме ср далеких от
изотопного стандарта это упрощение может привести к значительным ошибкам в
результатах, превышающим доверительные интервалы эмпирических величин,
используемых в моделях (до 3-9o/oo). Поэтому в методе Омото желательно
использовать вместо выражения (5.2) точное уравнение изотопного обмена в форме
 , ,
с расчетом уравнения сохранения
по каждому изотопу, либо в форме:
 , ,
как это сделано в работе [Bowers,
Taylor, 1985].
С учетом этих поправок, можно полагать, что при решении геохимических задач
метод Омото и метод изотопно-химической системы фактически эквивалентны по получаемым
результатам, и выбор того или другого может быть обусловлен практическими обстоятельствами
- доступностью соответствующих программных средств и предоставляемыми ими удобствами.
Так, например в работе [Банникова, 1990], успешно использованы расчетные данные,
полученные обоими методами.
|

