|
Ковальский Андрей Михайлович
Автореферат диссертации на соискание ученой
степени кандидата геолого-минералогических наук |
содержание |
Для расчета избыточных объемов
смешения в качестве опорных использовались
значения параметров ячеек альбита и
стронциевого цельзиана, рассчитанных в
настоящей работе, а также данные работ Кролля и
др. (1986) и Нагера (1974). Данные автора хорошо
согласуются с результатами Бамбауэра и др. (1984). Избыточный объем
смешения описывается двупараметрической
моделью Маргулеса по уравнению:
Vex=XSrFsp . (1- XSrFsp)
. [W1 . XSrFsp+W2 . (1- XSrFsp)]
Параметры модели
следующие: W1=1.24(18); W2=7.02(36) см3/моль.
На основе
полученных экспериментальных данных по
растворению твердых растворов полевых шпатов и
термодинамических характеристик ряда оксидов и
алюмосиликатов, приведенных в литературе,
рассчитаны энтальпии и свободные энергии Гиббса
образования синтезированных цельзиана (BaAl2Si2O8) и его Sr-
аналога (SrAl2Si2O8). По данным настоящей работы
для энтальпий образования SrAl2Si2O8
и BaAl2Si2O8
из оксидов получены
следующие значения:
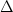 H f,ox298.15, Sr- цельзиан = -153.5 H f,ox298.15, Sr- цельзиан = -153.5 6.9 кДж/моль,
6.9 кДж/моль,
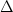 H f,ox298.15, Ba- цельзиан = -212.5 H f,ox298.15, Ba- цельзиан = -212.5 6.2 кДж/моль.
6.2 кДж/моль.
При расчете
энтальпий образования Sr и Ba- цельзианов из элементов
получены значения:
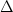 H f,el298.15, Sr- цельзиан = -4241.9 H f,el298.15, Sr- цельзиан = -4241.9 7.4 кДж/моль,
7.4 кДж/моль,
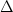 H f,el298.15, Ba- цельзиан = -4257.7 H f,el298.15, Ba- цельзиан = -4257.7 7.0 кДж/моль.
7.0 кДж/моль.
Оценку
отсутствующих в литературе значений величины
энтропии проводили исходя из принципа
аддитивности обменных реакций с близким по
составу и структуре анортитом (CaAl2Si2O8) с использованием справочных
данных Роби и Хэмингуэя (1995). Полученные величины
(S 298.15,Sr-цельзиан=216.7 0.6 Дж/моль.
K, 0.6 Дж/моль.
K,
S 298.15,Ba-цельзиан=233.3 0.6 Дж/моль. K) использованы для расчета
энтропий образования этих соединений из
элементов: 0.6 Дж/моль. K) использованы для расчета
энтропий образования этих соединений из
элементов:
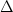 S f,el298.15, Sr- цельзиан = -753.81 S f,el298.15, Sr- цельзиан = -753.81 4.9 Дж/моль. K;
4.9 Дж/моль. K;
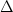 S f,el298.15, Ba- цельзиан = -743.94 S f,el298.15, Ba- цельзиан = -743.94 5.0 Дж/моль. K.
5.0 Дж/моль. K.
На основании полученных в настоящей
работе данных по энтальпиям образования
цельзианов и оцененных значений энтропий,
рассчитаны свободные энергии Гиббса
образования изученных цельзианов из элементов:
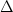 G f,el298.15, Sr- цельзиан = G f,el298.15, Sr- цельзиан = 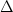 H f,el298.15, Sr-
цельзиан √ T.
H f,el298.15, Sr-
цельзиан √ T. 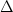 S f,el298.15,
Sr- цельзиан = S f,el298.15,
Sr- цельзиан =
= -4241.9 7.4 √ 298.15 . (-753.81 7.4 √ 298.15 . (-753.81 4.9). 10-3 = -4017.2
4.9). 10-3 = -4017.2 8.9 кДж/моль 8.9 кДж/моль
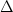 G f,el298.15, Ba- цельзиан = G f,el298.15, Ba- цельзиан = 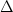 H f,el298.15, Ba-
цельзиан √ T.
H f,el298.15, Ba-
цельзиан √ T. 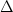 S f,el298.15,
Ba- цельзиан = S f,el298.15,
Ba- цельзиан =
= -4257.7 7.0 √ 298.15 . (-743.94 7.0 √ 298.15 . (-743.94 5.0). 10-3 = -4035.9
5.0). 10-3 = -4035.9 8.6 кДж/моль 8.6 кДж/моль
С целью обобщения
и согласования полученных экспериментальных и
имеющихся литературных данных о фазовых
равновесиях и результатов термохимических и
кристаллохимических исследований для систем
(Na,Sr)- и (Sr,Ba)- полевых шпатов, проведено
термодинамическое моделирование их твердых
растворов. Согласование проводилось по двум
методикам, описанным в работах Петухова (1997, 2001).
В работе использовались модели: I - с
линейной зависимостью избыточной свободной
энергии от температуры (H(Т)=const, S(Т)=const), II -
взаимосогласованных нелинейных температурных
зависимостей функций смешения (Петухов, 2001).
Избыточные энтальпия и энтропия определяются
через избыточную изобарную теплоемкость и, тем
самым, взаимосогласуются.
Термодинамические функции
твердых растворов (Na,Sr)- и (Sr,Ba)- полевых шпатов
по данным моделирования двумя описанными
методиками при давлении 2 кбар и температурах
600-900 С (параметры существования
полевошпатовых твердых растворов) различаются
незначительно. В результате моделирования
получены температурные зависимости свободных
энергий Гиббса обменных реакций:
1) 2NaAlSi3O8 + SrCl2 = SrAl2Si2O8
+ 2NaCl + 4SiO2
по модели I: 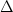 G = 3474.9 √ T . (-23.7) Дж/моль; G = 3474.9 √ T . (-23.7) Дж/моль;
по модели II: 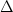 G= 3447.9 √ T . (-23.7) Дж/моль; G= 3447.9 √ T . (-23.7) Дж/моль;
1) BaAlSi3O8 + SrCl2 = SrAl2Si2O8
+ BaCl2
по модели I: 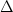 G= -11666.3 √ T . (-8.23) Дж/моль; G= -11666.3 √ T . (-8.23) Дж/моль;
по модели II: 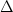 G= -13141.4 √ T . (-9.73) Дж/моль. G= -13141.4 √ T . (-9.73) Дж/моль.
| 
